Что такое элиминация вируса герпеса
Резюме. Ученые модифицировали CRISPR/Cas9-методику, сделав возможным деструкцию вирусов в латентной стадии развития
 Герпесвирусы ответственны за целый ряд инфекционных заболеваний человека, таких как опоясывающий лишай, герпетические высыпания, генитальный герпес и даже некоторые формы рака. Ученые Университетского медицинского центра Утрехта (University Medical Center, Utrecht), Нидерланды, смогли адаптировать революционную технику редактирования генома человека — CRISPR/Cas9, с помощью которой можно добиться элиминации вируса раз и навсегда. Результаты своей работы они опубликовали на страницах журнала «PLOS Pathogens».
Герпесвирусы ответственны за целый ряд инфекционных заболеваний человека, таких как опоясывающий лишай, герпетические высыпания, генитальный герпес и даже некоторые формы рака. Ученые Университетского медицинского центра Утрехта (University Medical Center, Utrecht), Нидерланды, смогли адаптировать революционную технику редактирования генома человека — CRISPR/Cas9, с помощью которой можно добиться элиминации вируса раз и навсегда. Результаты своей работы они опубликовали на страницах журнала «PLOS Pathogens».
Сегодня известно 8 типов герпесвирусов, которые способны инфицировать организм человека. Единожды попав в организм, вирус способен находиться в клетке в латентном состоянии до конца жизни носителя, реактивируясь в некоторых условиях и вызывая симптомы заболевания.
CRISPR/Cas9 — новая технология, позволяющая поражать и повреждать геном организма путем вырезания, добавления или замены частей нитей ДНК нуклеазой Cas9. Разработка этой технологии вызвала большой ажиотаж в научном мире, поскольку ее использование может помочь преодолеть множество разнообразных заболеваний. Ранее в журнале «Science» были опубликованы результаты исследования, в котором с помощью CRISPR/Cas9 ученые возобновили функцию мышечной ткани на модели мышей с мышечной дистрофией Дюшенна.
В текущем исследовании нидерландские ученые сосредоточились на 3 типах герпесвирусов: вирусе простого герпеса 1-го типа (Herpes simplex virus type 1 — HSV-1), цитомегаловирусе человека (Human cytomegalovirus — HCMV) и вирусе Эпштейна — Барр (Epstein — Barr virus — EBV). HSV-1 вызывает лабиальный герпес и HSV-ассоциированный кератит, HCMV может стать причиной врожденных пороков развития, EBV вызывает инфекционный мононуклеоз и некоторые виды рака, например лимфому Беркитта.
Ученые адаптировали CRISPR/Cas9, включив в нее направляющую РНК, молекулу, помогающую поражать важные части вирусного генома. Используя EBV-инфицированную лимфомную клетку, они выявили, что направляющая РНК способна ориентироваться на определенные последовательности ДНК EBV в латентной фазе его существования, запуская процесс мутации в данном участке. Это приводит к потере функции EBV, дестабилизируя ДНК молекулы вируса. Используя две специфические направляющие РНК для целевого воздействия на важные для EBV функции, исследователям удалось элиминировать 95% EBV, находящихся в латентной фазе в середине лимфомной клетки.
Затем ученые применили модифицированную методику к HCMV, установив, что определенные направляющие РНК нарушают репликацию в активную фазу. Кроме того, они идентифицировали варианты вируса, способные избежать «редакции», что означает необходимость применения CRISPR/Cas9-технологии к нескольким сайтам вируса одновременно во избежание развития резистентности.
При использовании методики в отношении HSV-1 установлено ее способность снижать репликацию вируса в активной фазе. При сочетании двух направляющих РНК ученые добились полной остановки репликации вируса. Однако они не смогли использовать технологию в латентную фазу.
Таким образом, голландские ученые верят, что применение CRISPR/Cas9 может стать эффективным методом элиминации герпесвирусов.
- van Diemen F.R., Kruse E.M., Hooykaas M.J. et al. (2016) CRISPR/Cas9-mediated genome editing of herpesviruses limits productive and latent infections. PLoS Pathog., 12(6): e1005701.
- Whiteman H. (2016) Herpesviruses could be eradicated with gene-editing technique. Medical News Today, 1 July (https://www.medicalnewstoday.com/articles/311329.php).
Анна Антонюк
Источник
Роза Исмаиловна Ягудина, д. фарм. н., проф., зав. кафедрой организации лекарственного обеспечения и фармакоэкономики и зав. лабораторией фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова.
Евгения Евгеньевна Аринина, к. м. н., ведущий научный сотрудник лаборатории фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова.
Герпес (herpes simplex) — это хроническое персистирующее заболевание, характеризующееся высыпанием групп пузырьков (везикул) на коже и слизистых оболочках. Его возбудители принадлежат к семейству герпесвирусов (Herpesviridae), которое в свою очередь подразделяется на три подсемейства: α, β и γ. У человека наиболее часто встречаются нейротрофные нейроинвазивные вирусы простого герпеса (ВПГ) двух видов: ВПГ-1 и ВПГ-2, которые относятся к подсемейству α и поражают нервную систему и слизистые оболочки. Они очень эффективно обходят иммунную систему человека, чем можно объяснить длительный скрытый период болезни, позволяющий вирусу максимально распространиться в организме.
ВПГ внедряется в клетки эпителия (слизистой полости рта, глотки или половых органов), где происходит его размножение. Пораженные клетки гибнут, в очаг воспаления мигрируют лимфоциты и макрофаги, происходит выброс биологически активных веществ, повреждение капилляров и соединительной ткани. Затем вирус проникает в чувствительные нервные окончания и по центростремительным нервным волокнам — в паравертебральные ганглии. В ядрах нейронов происходит репликация вируса, цикл репродукции продолжается около 10 часов с образованием в клетке от 50 до 200 тысяч вирионов. При нормальном иммунном ответе через 2–4 недели после заражения происходит разрешение первичного заболевания и элиминация ВПГ из тканей и органов. Однако в паравертебральных ганглиях возбудитель в латентном состоянии сохраняется в течение всей жизни. В любой момент может начаться реактивация размножения ВПГ и его перемещение по нервным волокнам к месту первичного вхождения (воротам инфекции) с рецидивом специфического инфекционно-воспалительного процесса и возможной диссеминацией инфекции.
Причины возникновения и распространение вируса простого герпеса
ВПГ устойчив к действию низких температур: от –20 до –70 °С он сохраняет жизнеспособность 10 и более лет, также как и после лиофильного высушивания. Однако ВПГ не устойчив к нагреванию: при 50–52 °С инактивируется через 30 минут, а при 37 °С — в течение 10 часов. Быстрее всего вирус разрушается под действием ультрафиолетовых и рентгеновских лучей, этилового спирта, эфира и других органических растворителей, протеолитических ферментов. На поверхности кожи и на влажных предметах при комнатной температуре ВПГ сохраняет жизнеспособность в течение 1–4 часов.
Источник распространения вируса герпеса — больные и инфицированные люди. При активной (манифестной) форме он выделяется с кровью, мочой, слюной, другими биологическими жидкостями (содержимое везикул, слезы, менструальная кровь, вагинальное и цервикальное отделяемое, сперма). При латентной форме (вирусоносительстве) ВПГ выделяется таким же образом, но в меньших количествах. Носительство активного вируса чаще всего наблюдается в течение первых 12 месяцев с момента инфицирования. Но при иммунодефицитных состояниях продолжительность этого периода может увеличиваться.
От человека к человеку ВПГ передается разными путями:
- контактно-бытовым;
- половым;
- парентеральным;
- вертикальным (от матери к плоду);
- аэрозольным.
Контактно-бытовой, половой и парентеральный механизмы передачи объединяют в один, называемый «перкутанным».
Наиболее распространена передача ВПГ контактно-бытовым путем — через посуду, предметы личной гигиены, предметы быта, постельное белье, также возможно заражение при поцелуях. В зависимости от механизма передачи вируса выделяют несколько клинических форм этого заболевания. Так, к группе риска при половом и парентеральном способах передачи относятся люди, имеющие беспорядочные половые связи, употребляющие наркотические препараты.
Клиническая картина
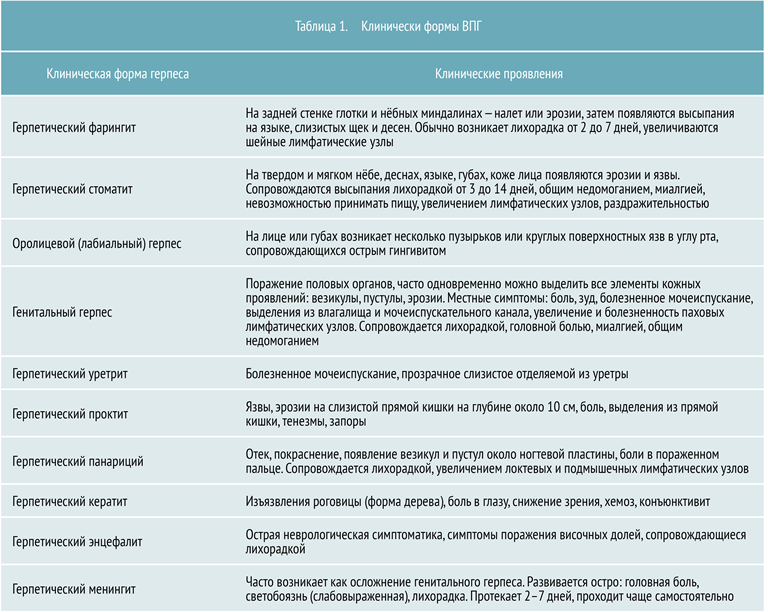
В зависимости от участков поражения выделяют несколько клинических форм ВПГ, представленных в таблице 1.
Первичный и вторичный герпес
Заболевание может протекать в следующих формах:
- Герпес первичный
- Герпес рецидивирующий
Первичный герпес чаще всего проявляется стоматитом или фарингитом, в основном у детей и молодых людей. Его инкубационный период составляет в среднем около недели. Общие признаки для всех клинических форм ВПГ: лихорадка, озноб, увеличение регионарных лимфоузлов.
У новорожденных ВПГ протекает в виде острого гингивостоматита, сопровождающегося эрозиями, язвами, некрозом на фоне отека и гиперемии слизистых оболочек.
Факторы риска при рецидивирующей форме герпеса: повышенное физическое или эмоциональное напряжения, общее истощение организма, различные виды лихорадки, травмы, гормональные изменения, поражение кожных покровов, хронические заболевания, переохлаждение, употребление алкоголя и наркотических препаратов, беспорядочная половая жизнь. При рецидиве вирус, находящийся в латентной стадии, активируется. В результате множество вирионов продвигаются по отросткам нейрона и переходят в эпителий кожи и слизистых оболочек. Рецидивирующий герпес развивается на фоне ограниченной гиперемии, с появлением пузырьков, содержащих прозрачный экссудат. Пузырьки обычно располагаются группами, в местах первичного поражения, там же обычно возникают жжение, покалывание и болезненность. Общее состояние человека при этом обычно не изменяется, но иногда может повышаться температура. Содержимое пузырьков может ссыхаться в корку, которая затем отпадает, или пузырьки вскрываются, образуя эрозию. В среднем рецидив герпеса клинически длится около 1–1,5 недели.
После первичного заражения ВПГ навсегда встраивается в геном клетки-хозяина и никогда не элиминируется иммунной системой.
ВПГ имеет циклическую активность (в течение 2–21 дня формируются пузырьки с вирусными частицами), периоды ремиссии, во время которых язвочки пропадают. Цикл репродукции вируса составляет 10 часов. Постепенно у человека формируется противовирусный иммунитет, и частота и тяжесть рецидивов уменьшается.
Формы и симптомы вируса герпеса 1 и 2 типа
Диагностика вируса герпеса: симптомы и лабораторные исследования
Диагностика ВПГ складывается из данных клинического осмотра и результатов лабораторных исследований, особенно значимых при латентной форме.
Оральный (лабиальный) герпес легко диагностируется лишь при наличии внешних проявлений — везикул, ран или язв. На ранних стадиях, когда симптомы заболевания отсутствуют, диагностировать герпес можно только лабораторными методами, который подтверждается при выделении вируса в культуре клеток и четырехкратном повышении титра антител при активной форме заболевания.
Для подтверждения диагноза и выбора терапии используется цитологический метод (в соскобах со дна везикул, окрашенных по Райту, Романовскому — Гимзе, видны характерные для герпеса гигантские клетки с внутриядерными включениями). Однако этот метод малочувствителен и не позволяет, например, отличить ВПГ от опоясывающего лишая.
Серологический метод с IgM и иммуноточечным гликопротеином G-специфичному HSV-тесту даёт более чем 98‑процентную специфичность и позволяет, таким образом, различить HSV-1 и HSV-2 типы герпеса.
Фармакотерапия: как вылечить герпес
В настоящее время существуют два основных направления в лечении вируса простого герпеса в организме человека:
- противовирусная терапия
- комплексная — иммунотерапия (специфическая + неспецифическая) + противовирусная
Противовирусная фармакотерапия
Ацикловир — противовирусный (противогерпетический) препарат, синтетический аналог нуклеозида тимидина, обладающий высокоизбирательным действием на вирусы герпеса. Внутри инфицированных клеток под действием вирусной тимидинкиназы проходит ряд последовательных реакций трансформации ацикловира в моно-, ди- и трифосфат ацикловира. Ацикловир трифосфат встраивается в цепочку вирусной ДНК и блокирует ее синтез посредством конкурентного ингибирования вирусной ДНК-полимеразы.
Специфичность и весьма высокая селективность действия также обусловлены его преимущественным накоплением в клетках, пораженных вирусом. Эффективен для большинства видов ВПГ, но лучший эффект достигается в лечении инфекций, вызванных herpes simplex типов 1 и 2, varicella zoster, слабее влияет на вирус Эпштейна — Барр и цитомегаловирусы.
После приема внутрь биологическая доступность ацикловира составляет 15–30 %, при этом создаются дозозависимые концентрации, достаточные для эффективного лечения вирусных заболеваний. Хорошо проникает во многие органы, ткани и жидкости организма, проникает через гематоэнцефалический и плацентарный барьеры, накапливается в грудном молоке. Связывание ацикловира с белками плазмы составляет 9–33 % и не зависит от его концентрации в плазме. Пища не оказывает значительного влияния на всасывание. Побочные реакции: тошнота, рвота, диарея, преходящее незначительное повышение активности ферментов печени, небольшое повышение концентрации мочевины и креатинина, гипербилирубинемия, головная боль, головокружение, анафилактические реакции, кожная сыпь, синдром Лайелла, синдром Стивенса — Джонсона, зуд, крапивница, сыпь, в том числе сенсибилизация. Таблетки и инъекционные формы ацикловира противопоказаны детям до 3‑х лет
Валацикловир — хлористоводородная соль L-валилового эфира ацикловира. Это пролекарство в организме абсорбируется из ЖКТ и при «первом прохождении» через кишечник и/или печень вследствие ферментативного гидролиза быстро и почти полностью (99 %) превращается в L-валин и ацикловир, который после фосфорилирования приобретает специфическую активность.
Побочные реакции: тошнота, рвота, гастралгия, снижение аппетита, повышение активности ACT, головокружение, головная боль, утомляемость, почечная недостаточность, микроангиопатия, гемолитическая анемия. Не зависит от приема пищи.
Пенцикловир — противовирусный препарат, активен в отношении вирусов herpes simplex 1 и 2 типа и varicella zoster. Пенцикловир попадает в инфицированные вирусом клетки, где под действием вирусной тимидинкиназы быстро превращается в монофосфат, который в свою очередь при участии клеточных ферментов переходит в трифосфат. Пенцикловира трифосфат находится в инфицированных вирусами клетках более 12 часов, подавляя в них синтез вирусной ДНК (дезоксирибонуклеиновой кислоты) и репликацию вирусов. Биодоступность пенцикловира — 77 %.
Побочные реакции: возможны жжение, пощипывание или онемение сразу же после нанесения препарата.
Фамцикловир — после приема внутрь фамцикловир быстро и почти полностью всасывается и превращается в активный пенцикловир.
Побочные реакции: головная боль, головокружение, повышение концентрации билирубина и активности «печеночных» трансаминаз, тошнота, рвота, диарея, боль в животе, кожная сыпь, зуд, повышенная потливость.
Ганцикловир — синтетический аналог 2′-дезоксигуанозина, который подавляет размножение вирусов герпеса. Активен в отношении цитомегаловируса человека (ЦМВ), вирусов простого герпеса 1‑го и 2‑го типа, вирусов герпеса человека 6, 7 и 8 типа, Эпштейна — Барр, ветряной оспы и гепатита В. В инфицированных клетках под действием вирусной протеинкиназы UL97 ганцикловир вначале фосфорилируется с образованием ганцикловира монофосфата, под действием клеточных киназ переходит в трифосфат, а затем подвергается медленному внутриклеточному метаболизму. Так как фосфорилирование ганцикловира в большой степени зависит от действия вирусной киназы, оно происходит преимущественно в инфицированных клетках. Рекомендуется принимать во время еды.
Валганцикловир — L-валиловый эфир (пролекарство) ганцикловира, после приема внутрь быстро превращающийся в ганцикловир под действием кишечных и печеночных эстераз. Рекомендуется принимать во время еды.
Все перечисленные выше препараты — средства «скорой помощи» при любых формах герпеса.
Иммунотерапия простого герпеса
Нарушение иммунного ответа — одно из важнейших звеньев в патогенезе простого герпеса, так как часто заболевание протекает на фоне подавления иммунных реакций. Происходит снижение общего количества Т- и В-клеток, изменение их функциональной активности, наблюдаются нарушения в макрофагальном звене иммунитета, в системе интерферона.
Неспецифическая иммунотерапия включает в себя использование:
- иммуноглобулина;
- интерферонов и индукторов интерферона;
- препаратов, стимулирующих Т- и В-звенья клеточного иммунитета и фагоцитоз.
Механизм действия иммуноглобулинов при герпесе длительное время объясняли заместительным эффектом на фоне присущей этому заболеванию несостоятельности гуморального иммунитета. В последние годы было установлено, что препараты иммуноглобулинов обладают также иммуномодулирующим и антитоксическим действием, активируют опсоно-фагоцитарные реакции.
Для лечения рецидивирующего герпеса применяют иммуноглобулин человеческий нормальный. Препарат содержит достаточное для достижения терапевтического эффекта количество специфических противогерпетических антител.
Интерферон (ИФ) — фактор естественного иммунитета, продуцируется клетками в ответ на воздействие вирусов, бактерий, чужеродных антигенов и активирует реакцию элиминации возбудителей инфекции. Помимо противовирусной активности интерферон обладает антипролиферативным и иммунорегулирующим действием. ИФ повышает неспецифическую резистентность клеток (стимулирует фагоцитоз, увеличивает активность естественных киллеров). Широкий спектр противовирусной активности, отсутствие резистентных к интерферону штаммов вирусов предопределили перспективу его использования как средства этиопатогенетической терапии простого герпеса.
Для лечения различных форм рецидивирующего герпеса используются рекомбинантный альфа-2а интерферон и созданный комбинированный препарат, который состоит из иммуноглобулинов и рекомбинантного альфа-2а интерферона в виде суппозиториев для ректального и вагинального введения.
С помощью препаратов интерферона (природных или генно-инженерных) осуществляется заместительная терапия, в результате чего может блокироваться продукция собственного эндогенного ИФ пациента. Это необходимо принимать во внимание при назначении длительных (более двух недель) курсов ИФ-терапии, особенно генно-инженерных форм. В случаях длительного назначения больным ИФ отменять их следует постепенно, снижая частоту приема до трех, далее двух раз в неделю с последующей полной отменой препарата.
Тилорон, тетрагидроксиглюкопиранозилксантен — индукторы ИФ, стимулируют выработку эндогенного ИФ в организме больного. Это объясняет терапевтический эффект перечисленных препаратов при многих вирусных заболеваниях (рецидивирующем герпесе, гриппе, аденовирусной инфекции), что позволяет рекомендовать их в комплексном лечении всех герпетических заболеваний, особенно у больных, страдающих частыми простудными заболеваниями и ОРВИ.
Специфическая иммунотерапия состоит в применении герпетической вакцины (поливалентной, тканевой, инактивированной). Лечебный эффект вакцины связан со стимуляцией специфических реакций противовирусного иммунитета, восстановлением функциональной активности иммунокомпетентных клеток и специфической десенсибилизацией организма.
Комплексное лечение вируса простого герпеса
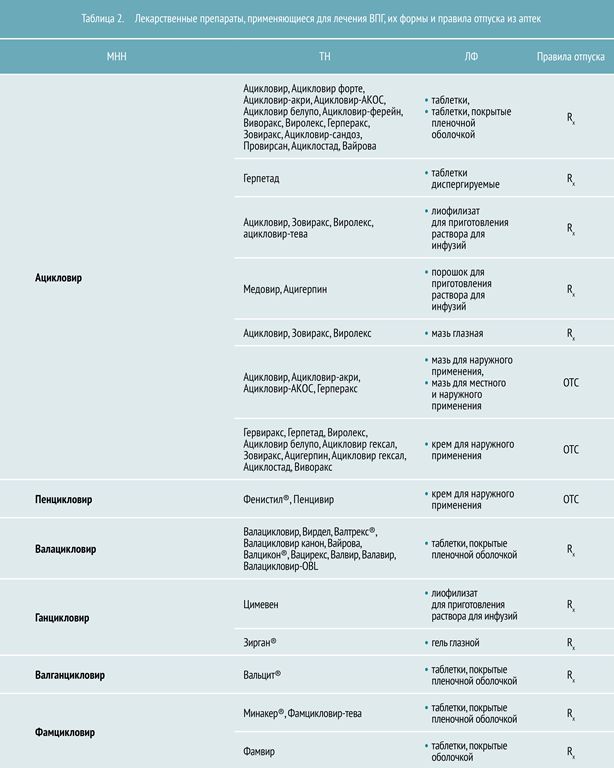
Учитывая патогенез, целесообразно использовать препараты с различным механизмом действия. Это препятствует появлению резистентных штаммов ВПГ, а применение интерферонов и их индукторов в сочетании с герпетической вакциной и иммуномодуляторами позволяет комплексно решать вопросы терапии. В таблице 2 представлены препараты, зарегистрированные на территории РФ для лечения ВПГ.Препараты при лечении вируса герпеса

Источник


