Для чего днк герпеса
Вирус простого герпеса (ВПГ) – ДНК–содержащий вирус Herpes simplex virus семейства Herpesviridae подсемейства Alphaherpesvirinae. Согласно статистическим данным ВОЗ, инфекции, обусловленные ВПГ, занимают второе место по распространенности среди вирусных заболеваний человека. Различают два серотипа ВПГ – ВПГ-1 и ВПГ-2. Оба типа вируса вызывают инфекционные заболевания человека различной степени тяжести от характерных везикулезных или пустулезных высыпаний на коже и слизистых до поражений ЦНС. ВПГ-1 – причина офтальмогерпеса, протекающего в форме кератита или кератоиридоциклита, реже увеита, в единичных случаях — ретинита, блефароконъюнктивита. Заболевание может привести к помутнению роговицы и вторичной глаукоме. ВПГ-1 — основная причина энцефалита у взрослого населения стран умеренного климата, при этом только у 6–10% больных отмечается одновременное поражение кожи.
В ходе проведения эпидемиологических исследований установлено наличие специфических АТ к ВПГ у 90–95% обследуемых лиц среди взрослого населения, при этом первичная инфекция манифестно протекает лишь у 20–30% инфицированных.
ВПГ характеризуется коротким циклом репродукции в клеточных культурах и оказывает сильное цитопатическое действие. Он способен к репродукции в различных типах клеток, чаще персистирует в ЦНС, преимущественно в ганглиях, поддерживая латентную инфекцию с возможностью периодической реактивации. Наиболее часто вызывает кожно-слизистые формы заболевания, а также поражение ЦНС и глаз. Геном ВПГможет интегрироваться с генами других вирусов (включая ВИЧ), вызывая их активацию, также возможен его переход в активное состояние на фоне развития иных вирусных и бактериальных инфекций.
Пути передачи ВПГ: воздушно-капельный, половой, контактно-бытовой, вертикальный, парентеральный. Факторами передачи ВПГ служат кровь, слюна, моча, везикулярный и вагинальный секрет, сперма. Входными воротами являются поврежденные слизистые оболочки и кожа. По периферическим нервам вирус доходит до ганглиев, где сохраняется пожизненно. При активации ВПГ распространяется по нерву к первоначальному очагу поражения (механизм “замкнутого цикла” – циклическая миграция вируса между ганглием и поверхностью кожи). Может происходить лимфогенная и гематогенная диссеминация возбудителя, что особенно характерно для недоношенных новорожденных и лиц с выраженным иммунодефицитом (в т. ч. при ВИЧ-инфекции). ВПГ обнаруживается на лимфоцитах, эритроцитах, тромбоцитах, при проникновении вируса в ткани и органы возможно их повреждение вследствие его цитопатического действия. Сохраняющиеся в течение всей жизни у человека вируснейтрализующие АТ (даже в высоких титрах), хотя и препятствуют распространению инфекции, но не предупреждают рецидивов.
Выделение ВПГ продолжается значительное время при первичном инфицировании (ДНК выявляется в плазме крови в течение 4–6 недель), при рецидивах – не более 10 дней. Формирование противогерпетического иммунитета происходит как при манифестном, так и при бессимптомном течении инфекции. При первом контакте АГ с клетками иммунной системы в течение 14–28 дней формируется первичный иммунный ответ, который у иммунокомпетентных лиц проявляется образованием интерферонов, выработкой специфических АТ (вначале – IgM, впоследствии – IgA и IgG), повышением активности естественных киллеров – NK-клеток и формированием мощного пула высокоспециализированных киллеров. В случае реактивации или реинфекции возникает повторный контакт клеток иммунной системы с АГ, образуются АТ и Т-киллеры. Реактивация сопровождается продукцией АТ IgM (редко даже при наличии типичных высыпаний), АТ IgА (чаще) и IgG.
ВПГ (преимущественно ВПГ-2) вызывает генитальный герпес – хроническое рецидивирующее заболевание. Клинические проявления первичного эпизода инфекции, вызванной разными типами вируса сходны, однако инфекции, вызванной ВПГ-2, в гораздо большей степени свойственен рецидивирующий характер. Передача вируса происходит при половых контактах, очаг инфекции локализуется на слизистой и коже половых органов и перигенитальной зоны. Размножение вируса в клетках эпителия приводит к образованию очага сгруппированных пузырьков (папул, везикул), в которых содержатся вирусные частицы, сопровождается покраснением, зудом. Первичный эпизод протекает острее (обычно с симптомами интоксикации), чем последующие рецидивы. Часто возникают симптомы дизурии, признаки эрозии шейки матки.
На ранних стадиях ВИЧ-инфекции течение заболеваний, вызванных ВПГ-1 или ВПГ-2, короткое и типичное. Частым признаком углубления иммуносупрессии и перехода латентной стадии ВИЧ-инфекции в стадию вторичных заболеваний служит развитие опоясывающего лишая. Наличие стойких глубоких вирусных поражений кожи, повторный или диссеминированный опоясывающий лишай, локализованная саркома Капоши — одни из клинических критериев стадии вторичных заболеваний ВИЧ-инфекции. У больных с количеством CD4+-клеток менее 50 клеток/мкл отсутствует тенденция к самостоятельному заживлению эрозивно-язвенных дефектов. Частота герпетического энцефалита среди поражений ЦНС при ВИЧ-инфекции — около 1–3%. У больных СПИДом с наличием глубокого иммунодефицита заболевание нередко протекает атипично: болезнь начинается подостро и медленно прогрессирует до тяжелейших проявлений энцефалита.
Герпетическая инфекция даже при бессимптомном течении способна вызвать целый ряд патологий у беременной и новорожденного. Наибольшую угрозу репродуктивной функции представляет генитальный герпес, который в 80% случаев обусловлен ВПГ-2 и в 20% – ВПГ-1. Бессимптомное течение чаще имеет место у женщин и более типично для ВПГ-2, чем для ВПГ-1. Первичное инфицирование или рецидивы во время беременности наиболее опасны для плода, поскольку могут привести к самопроизвольному выкидышу, гибели плода, мертворождению, порокам развития. Заражение плода и новорожденного чаще отмечается при бессимптомном течении генитального герпеса, чем при клинически выраженном типичном течении. Новорожденный может приобрести герпетическую инфекцию внутриутробно, во время родов (в 75–80% случаев), либо постнатально.
ВПГ-2 может проникать в полость матки через цервикальный канал с поражением плода в 20–30% случаев; трансплацентарное инфицирование может происходить в 5–20% случаев, инфицирование во время родов – в 40% случаев. Возможна передача вируса при выполнении медицинских процедур. При типичных клинических проявлениях диагноз герпетической инфекции трудностей не представляет, тогда как при атипичных формах верифицируется на основании результатов лабораторных исследований, при этом приоритетными должны быть исследования, направленные на выявление маркеров текущей (активной) инфекции. Активация инфекционного процесса при герпетической инфекции, даже при наличии клинических проявлений в стадии обострения, редко сопровождается выработкой АТ-ВПГ IgM (чаще – при первичной инфекции либо реинфекции), как правило, при этом отмечают появление АТ-ВПГ IgА.
Целесообразными являются диагностические исследования для обнаружения ВПГ или его маркеров при наличии в анамнезе пациента указаний на рецидивирующую инфекцию либо на дебют герпетической инфекции в период беременности.
Дифференциальная диагностика. При наличии инфекционного синдрома (длительный субфебрилитет, лимфаденопатия, гепато- или гепатоспленомегалия) – токсоплазмоз, цитомегаловирусная инфекция и инфекция, вызванная ВЭБ; контактный дерматит, инфекционные заболевания, сопровождающиеся везикулезными высыпаниями на коже и слизистых оболочках (ветряная оспа, опоясывающий герпес, пиодермия и др.); эрозивно–язвенные поражения гениталий, обусловленные Treponema pallidum, Haemophilus ducreyi; болезнь Крона, синдром Бехчета, фиксированная токсикодермия, менингоэнцефалиты и менингиты неясной этиологии, увеиты и кератоконъюнктивиты неясной этиологии).
Показания к обследованию
- Планирование беременности;
- женщины, имеющие в анамнезе либо на момент обращения типичные герпетические высыпания любой локализации, в т. ч. рецидивирующий генитальный герпес, или наличие пузырьковых и/или эрозивных высыпаний на коже, ягодицах, бедрах, слизисто–гнойные выделения из влагалища;
- наличие полового контакта с партнером, имеющим генитальный герпес;
- атипичная форма заболевания: отсутствие зуда или жжения, отсутствие везикул, веррукозные узелки; обширные кожные поражения (до 10% случаев предполагаемого опоясывающего герпеса обусловлено не ВЗВ, а ВПГ);
- женщины с отягощенным акушерским анамнезом (перинатальные потери, рождение ребенка с врожденными пороками развития);
- беременные женщины (в первую очередь имеющие УЗИ-признаки внутриутробной инфекции, лимфоаденопатии, лихорадку, гепатит и гепатоспленомегалию неясного генеза);
- дети с признаками внутриутробной инфекции, врожденными пороками развития или наличием на коже или слизистых оболочках везикул или корочек;
- дети, рожденные от матерей, перенесших генитальный герпес во время беременности;
- ациенты (в первую очередь новорожденные) с сепсисом, гепатитами, менингоэнцефалитом, пневмонией, поражением глаз (увеит, кератит, ретинит, ретинальный некроз), поражением ЖКТ.
Материал для исследования
- Содержимое пузырьков/везикул со слизистых оболочек и кожи половых органов мужчин и женщин – микроскопические исследования, культуральные исследования, выявление АГ, выявление ДНК;
- мазки (соскобы) со слизистых оболочек цервикального канала, уретры (при отсутствии видимых пузырьковых высыпаний или эрозивно-язвенных поражений) – выявление ДНК;
- сыворотка крови, СМЖ (по показаниям) – выявление АТ.
Этиологическая лабораторная диагностика включает микроскопическое исследование, выделение и идентификация вируса в культуре клеток, выявление АГ или ДНК возбудителя, определение специфических АТ.
Сравнительная характеристика методов лабораторной диагностики (вирус простого герпеса — анализ). Среди методов лабораторной диагностики “золотым стандартом” долгое время считали выделение ВПГ в культуре клеток из крови, СМЖ, содержимого везикулезных или пустулезных высыпаний и других локусов (носоглотки, конъюнктивы, уретры, влагалища, цервикального канала). Данный метод предполагает изоляцию вируса при заражении биологическим материалом чувствительных культур клеток с его последующей идентификацией. К неоспоримым преимуществам метода относятся: возможность определения активности инфекции при наличии клинических проявлений и проведения типирования вируса, а также установления чувствительности к противовирусным препаратам. Однако длительность анализа (1–8 дней), трудоемкость, высокая стоимость и необходимость определенных условий проведения исследований затрудняет применение данного метода для рутинной лабораторной диагностики заболевания. Чувствительность достигает 70–80%, специфичность – 100%.
Материал с поверхности высыпаний может быть использован для микроскопических (окраска препаратов по Романовскому–Гимзе) или цитологических (окраска препаратов по Тцанку и Папаниколау) исследований. Названные процедуры имеют низкую диагностическую специфичность (не позволяют дифференцировать ВПГ от других герпес-вирусов) и чувствительность (не более 60%), поэтому не могут считаться надежными методами диагностики.
Выявление АГ ВПГ в крови, СМЖ, содержимом везикулезных или пустулезных высыпаний и других локусов (носоглотки, конъюнктивы, уретры, влагалища, цервикального канала) проводят методами РИФ и РНИФ с использованием моноклональных или высокоочищенных поликлональных АТ. При использовании метода ИФА чувствительность исследования возрастает до 95% и более, специфичность при манифестном герпесе варьирует от 62 до 100%. Однако большинство наборов реагентов для выявления антигена ВПГ методом ИФА не позволяют провести дифференцирование серотипов вируса.
Обнаружение ДНК ВПГ-1 и/или ВПГ-2 при использовании ПЦР в различном биологическом материале превосходит чувствительность обнаружения ВПГ при использовании вирусологического исследования. Выявление ВПГ в соскобах со слизистых оболочек полости рта, урогенитального тракта, в отделяемом пузырьковых высыпаний (везикул) и эрозивно–язвенных поражений кожи с помощью ПЦР является методом выбора. Несомненную ценность имеет определение количества ДНК ВПГ методом ПЦР в режиме реального времени, результаты исследования можно использовать как с диагностической целью, так и для оценки эффективности лечения.
Для выявления АТ к ВПГ разных классов IgА, IgG, IgM, суммарных к антигенам ВПГ обоих типов или типоспецифичных, применяют методы РНИФ или ИФА, для определения авидности АТ IgG – метод ИФА. Наибольшее диагностическое значение имеет детекция АТ IgM как показателя активности процесса, их выявление может свидетельствовать об остром заболевании, реинфекции, суперинфекции или реактивации. Однако в клинически выраженных случаях, в т. ч. при типичном течении генитального или неонатального герпеса, специфические АТ IgM выявляются редко (в 3–6% случаев). Определение авидности АТ-ВПГ IgG несет низкую информационную нагрузку: реактивация при клинически выраженных случаях сопровождалась наличием высокоавидных АТ. Тест на выявление АТ-ВПГ IgА является методом выбора наряду с определением ДНК либо АГ ВПГ при определении активности инфекционного процесса.
Показания к применению различных лабораторных исследований. Определение АТ целесообразно проводить для подтверждения первичной инфекции, а также установления диагноза у пациентов с бессимптомным и атипичным течением заболевания.
У беременных женщин (скрининг) целесообразно проведение исследований для выявления АТ-ВПГ IgМ, а также выявление АТ-ВПГ IgА. Для беременных высокого инфекционного риска дополнительно рекомендуется определение ДНК и АГ ВПГ в лейкоцитарной взвеси или в материале из предполагаемого очага.
При подозрении на внутриутробную инфекцию рекомендуется выявление ДНК вируса в пуповинной крови, у новорожденных – детекция ДНК вируса в различных биологических пробах (отделяемое пузырьковых высыпаний (везикул) эрозивно– язвенных поражений кожи и слизистых оболочек, ротоглотки, конъюнктивы; периферическая кровь, СМЖ, моча и др.), а также определение АТ-ВПГ IgМ и IgА в крови. Учитывая высокую диагностическую значимость определения ДНК вируса методом ПЦР и наличие зависимости между летальностью у новорожденных и виремией, вызванной ВПГ, некоторые исследователи рекомендуют использовать этот метод для лабораторного скрининга генерализованной герпетической инфекции детей, относящихся к группе высокого риска.
Выявление АГ-ВПГ в различных биологических пробах предлагается применять в качестве экспресс-тестов для дифференцирования типов вируса при скрининге популяций с высоким уровнем заболеваемости, а также при мониторинге заболевания.
У больных ВИЧ-инфекцией с атипичными клиническими проявлениями кожных поражений в диагностике отдается предпочтение выявлению ДНК ВПГ методом ПЦР как самому чувствительному методу лабораторной диагностики.
Особенности интерпретации результатов. Обнаружение вирусоспецифических АТ IgM может свидетельствовать о первичной инфекции, реже – о реактивации или реинфекции, выявление АТ-ВПГ IgА – об активности инфекционного процесса (затяжное течение при дебюте герпетической инфекции, реинфекции или реактивации). О врожденной инфекции (неонатальный герпес) свидетельствует присутствие АТ-ВПГ IgM и(или) IgА. Выявление АТ IgG отражает латентную инфекцию (инфицирование).
Выявление ДНК ВПГ свидетельствует о наличии активной (репликативной) стадии вирусной инфекции с учетом выраженности клинических проявлений. Выявление ДНК ВПГ-1 и/или ВПГ-2 методом ПЦР позволяет при однократном тестировании установить факт внутриутробного инфицирования плода; при проведении обследования в первые 24–48 ч после рождения лабораторно подтвердить врожденную инфекцию, вызванную ВПГ.
Диагностическое значение (специфичность и чувствительность) обнаружения ДНК ВПГ в СМЖ у больных ВИЧ-инфекцией с поражением ЦНС окончательно не установлены. Возможно, для подтверждения герпетической этиологии энцефалита необходимо определение концентрации ДНК ВПГ в СМЖ. Исследование для обнаружения ДНК ВПГ в крови малоинформативно в связи кратковременным нахождением ВПГ в сосудистом русле, следовательно, возможно получение отрицательного результата несмотря на развитие клинически выраженного заболевания.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 12 января 2018;
проверки требуют 72 правки.
Ге́рпес (греч. ἕρπης — ползучая, распространяющаяся кожная болезнь) — вирусное заболевание с характерным высыпанием сгруппированных пузырьков на коже и слизистых.
Описание[править | править код]
Наиболее часто вирус поражает:
- кожу, глаза (конъюнктивит, кератит),
- наружные половые органы
В тяжёлых случаях болезни возможно поражение центральной нервной системы с развитием менингита и энцефалита.
Развитию заболевания способствуют переохлаждение, снижение сопротивляемости организма. Возможен герпес и в жаркое время при перегревании организма.
У человека встречается 8 типов вирусов герпеса:
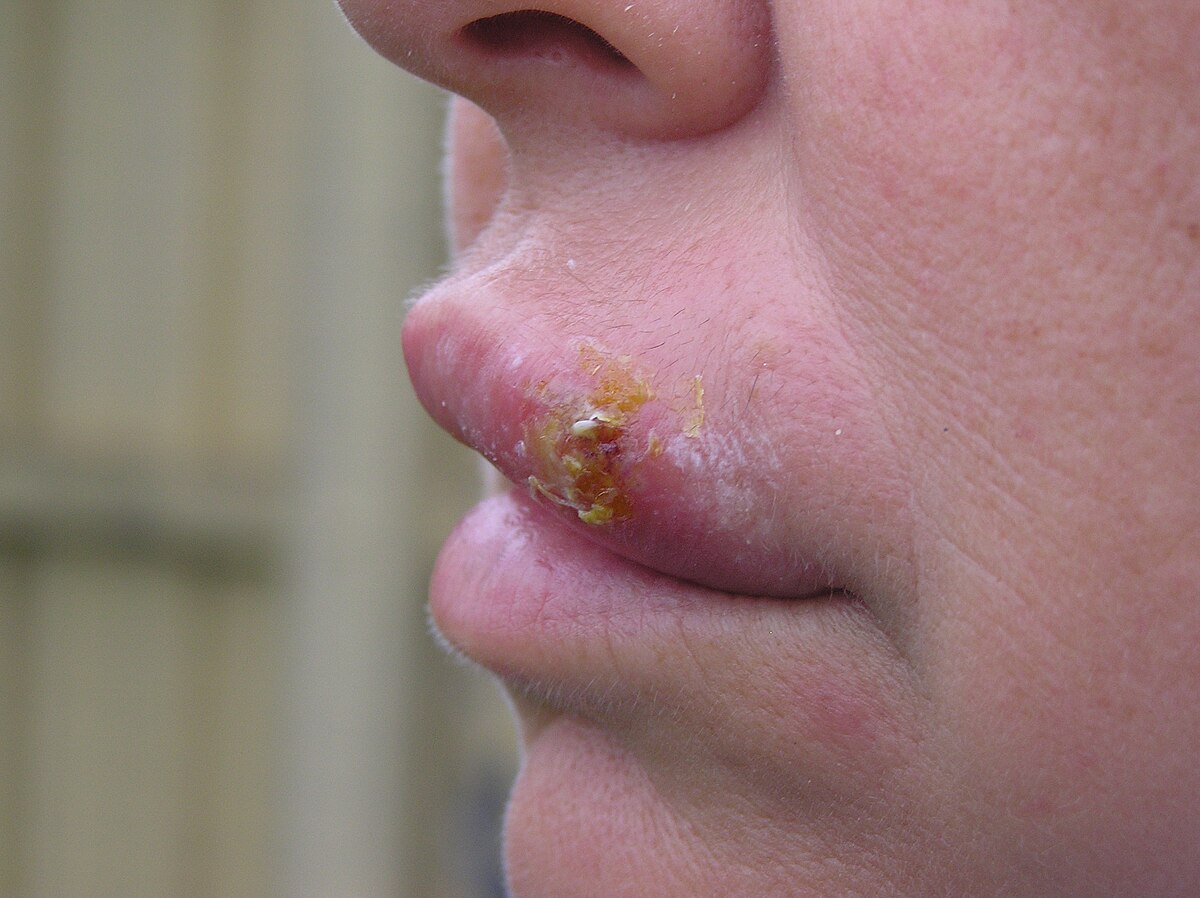
- Вирус простого герпеса 1-го типа — вызывает простой герпес, являющийся причиной пузырьков на губах («простуды»).
- Вирус простого герпеса 2-го типа — вызывает генитальный герпес, в большинстве случаев вызывающий генитальные проблемы.
- Вирус ветряной оспы — вызывает ветряную оспу (ветрянку) и опоясывающий лишай (herpes zoster), вирус 3 типа.
- Вирус Эпштейна — Барр — вызывает заболевание инфекционный мононуклеоз, вирус 4 типа.
- Цитомегаловирус — вызывает цитомегаловирусную инфекцию, вирус 5 типа.
Значение 6, 7 и 8 типов до конца не ясно. Полагают, что они играют роль в синдроме хронической усталости, появлении внезапной сыпи.
Симптомы[править | править код]
Простой герпес (Herpes simplex) — группа скученных пузырьков с прозрачным содержимым на воспалённом основании. Герпесу предшествует зуд, жжение кожи, иногда озноб, недомогание.
Опоясывающий лишай (Herpes zoster) — характеризуется болью по ходу нерва, головной болью. Через несколько дней на участке кожи по ходу нерва появляются высыпания в виде сгруппированных пузырьков сначала с прозрачным, а позже гнойным кровянистым содержимым. Увеличиваются лимфатические узлы, повышается температура тела, нарушается общее состояние. Невралгические боли могут держаться до нескольких месяцев.
Патогенез[править | править код]
Вирус герпеса передаётся непосредственным контактным путём, а также посредством предметов обихода. Согласно ВОЗ (Всемирной организации здравоохранения) вирус простого герпеса 1-го типа (ВПГ-1) передается главным образом через оральный контакт и вызывает оральную герпетическую инфекцию вследствие контакта с вирусом ВПГ-1 в простудных пузырьках, слюне и на поверхностях во рту или вокруг рта. Однако вследствие орально-генитального контакта ВПГ-1 может также попасть на генитальную область и вызвать генитальный герпес. О иных способах передачи (ВПГ-1) ВОЗ не сообщает[1]
Возможна также передача инфекции воздушно-капельным путём. Герпес проникает через слизистые оболочки полости рта, верхних дыхательных путей и половых органов. Преодолев тканевые барьеры, вирус попадает в кровь и лимфу. Затем попадает в различные внутренние органы.
Вирус проникает в чувствительные нервные окончания и встраивается в генетический аппарат нервных клеток. После этого удалить вирус из организма невозможно, он останется с человеком на всю жизнь. Иммунная система реагирует на проникновение герпеса выработкой специфических антител, блокирующих циркулирующие в крови вирусные частицы. Характерно пробуждение инфекции в холодное время года, при простудных заболеваниях, при гиповитаминозе. Размножение герпеса в клетках эпителия кожи и слизистых оболочек приводит к развитию дистрофии и гибели клеток.
Согласно исследованиям учёных Колумбийского университета, герпес является стимулирующим фактором для развития болезни Альцгеймера[2]. Позднее эти данные были независимо подтверждены исследователями из Манчестерского университета. Ранее та же группа исследователей под руководством Рут Ицхаки доказала, что вирус простого герпеса обнаруживается в мозге почти 70% пациентов с болезнью Альцгеймера. Кроме того, они подтвердили, что при инфицировании вирусом культуры клеток мозга происходит значительное увеличение уровня бета-амилоида, из которого и формируются бляшки. В ходе последнего исследования учёные смогли выяснить, что 90% бляшек в мозге пациентов с болезнью Альцгеймера содержат ДНК простого герпеса — ВПГ-1[3].
Лечение[править | править код]
В настоящее время способов гарантированного излечения от герпеса не найдено. Существуют, однако, препараты, которые при регулярном приёме способны эффективно подавлять симптомы заражения вирусом, его размножение и развитие (то есть повышать качество жизни больного):
- Ацикловир (Zovirax, Зовиракс и многочисленные дженерики). Противовирусный препарат, препятствующий размножению вируса в клетках. Лекарственная форма — таблетки, мазь, крем и раствор для инъекций. Относительно дёшев, эффективен для большинства пациентов.
- Валацикловир (Валцикон, Valcikon). Отличается от ацикловира не только способом доставки, но и обладает большей[источник не указан 1145 дней] эффективностью. В большинстве случаев полностью подавляет симптомы вируса и его биологическую активность, блокирует его размножение и с высокой вероятностью предотвращает передачу вируса другим партнёрам при контактах. В настоящее время на Западе этот препарат наряду с пенцикловиром является основным средством для лечения герпеса.[4]
- Фамцикловир (Фамвир, Famvir). Пероральная форма пенцикловира. Эффективен в отношении штаммов вируса Herpes zoster и Herpes simplex (в том числе устойчивых к ацикловиру и имеющих изменённую ДНК-полимеразу). Принцип действия схож с ацикловиром и валацикловиром. Обладает высокой эффективностью.
- Докозанол (Эразабан, Herpanit)[5]. Многоатомный насыщенный спирт, содержится в составе поликозанола. Используется в косметической промышленности в качестве смягчителя и эмульгатора. Обладает также противовирусными свойствами,[6][7] эффективность подтверждена плацебо-контролируемыми исследованиями FDA в 2000 году[8].
- Тромантадин (Tromantadine). Противовирусное средство для наружного применения. Активен в отношении вирусов Herpes simplex 1-го и 2-го типов, Herpes zoster. Ингибирует адсорбцию и проникновение вирусов внутрь клетки.
- Витагерпавак. Вакцина, содержащая специфические инактивированные антигены вирусов простого герпеса (ВПГ) Ι и ΙΙ серотипов, полученного путём репродукции в культуре перевиваемых клеток Vero B. Лечебный эффект герпетической вакцины связан со стимуляцией специфической реакции противовирусного иммунитета, усилением активности лимфоцитов больных, которая сохраняется в течение нескольких месяцев после окончания вакцинации.
- Аллокин-альфа по характеру фармакологического действия наиболее сходен с α-интерфероном. Лиофилизированный порошок или пористая масса белого цвета. Препарат вводят подкожно. Лечение хронического рецидивирующего герпеса 1 и 2 типов рекомендуется начинать при появлении самых первых признаков заболевания. Механизм действия препарата неизучен, за пределами РФ Аллокин-альфа неизвестен, клинических испытаний, подтверждающих эффективность препарата, не проводилось.
Генотерапия[править | править код]
Обнадёживающие результаты продемонстрированы при лечении клеток линии Vero, а также животных от герпесвирусов типа 1 (вирус простого герпеса, HSV-1), типа 4 (вирус Эпштейна — Барр, EBV) и типа 5 (цитомегаловирус человека, HCMV) методом CRISPR/Cas9. Для некоторых участков их ДНК были созданы направляющие молекулы РНК, благодаря которым нуклеазы Cas9 способны распознавать их в геноме хозяина и разрезать. Эксперименты показали, что разрез в одном участке вирусной ДНК снижает число заражённых клеток примерно вдвое, а два разреза приводят к почти полному удалению вирусов[9][10].
Исследования[править | править код]
Американские исследователи из университета Калифорнии в Сан-Франциско обнаружили один из механизмов, который вирус герпеса использует для размножения в клетках человека, и выяснили, каким образом его можно использовать в целях создания вакцины, сообщалось в статье журнала PNAS. Ной Варди и его коллеги раскрыли необычный механизм, который герпес и похожие на него патогены используют для запуска процесса саморазмножения в зараженных клетках, наблюдая за тем, как его ближайший родич, цитомегаловирус, «пробивается» через клеточные оборонительные системы, мешающие вирусам копировать себя.[11]
Возникновение рецидивов[править | править код]
Вирус, после подавления активной стадии, остается в нервных ганглиях, существует там латентно и довольно долго может никак не выдавать себя. На этой фазе новые вирусы не производятся. Причины рецидивов точно не установлены, но есть известные факторы, провоцирующие развитие и рецидивы вируса:
- изменения в иммунной системе женщин перед, после и во время месячных;
- инфекция ОРВИ, грипп и другие заболевания, сопровождающиеся высокой температурой;
- локальные повреждения в области губ или глаз;
- побочные эффекты лучевой терапии;
- сильный, холодный ветер;
- воздействие ультрафиолетового облучения.
При рецидивах уровень содержания антител класса IgG и IgM является повышенным.
Профилактика[править | править код]
Генитального герпеса[править | править код]
- Презервативы. Эффективность высока, но следует помнить, что она меньше 100%, так как передача вируса может осуществляться и через области слизистых оболочек и кожи (особенно при наличии на ней микротрещин и повреждений), не закрываемых презервативом.
- Антисептические средства (Мирамистин и подобные), которыми следует обрабатывать участки, на которые могло произойти попадание вируса. Степень эффективности определить трудно.
Ветряной оспы[править | править код]
- Вакцинация.
- Изоляция больных от непереболевших.
Примечания[править | править код]
- ↑ Вирус простого герпеса. www.who.int. Дата обращения 16 мая 2019.
- ↑ New Evidence Found Linking Herpes And Alzheimer’s (англ.)
- ↑ От герпеса до Альцгеймера недалеко
- ↑ Vere Hodge RA, Field HJ. Antiviral agents for herpes simplex virus. // Adv Pharmacol.. — 2013. — Т. 67. — С. 1—38. — DOI:10.1016/B978-0-12-405880-4.00001-9. — PMID 23885997.
- ↑ Drug Name: ABREVA (docosanol) (англ.)
- ↑ Chon T., Nguyen L., Elliott T.C. Clinical inquiries. What are the best treatments for herpes labialis? (англ.) // J Fam Pract : journal. — 2007. — July (vol. 56, no. 7). — P. 576—578. — PMID 17605952.
- ↑ Treister N.S., Woo S.B. Topical n-docosanol for management of recurrent herpes labialis (англ.) // Expert Opinion on Pharmacotherapy (англ.)русск. : journal. — 2010. — April (vol. 11, no. 5). — P. 853—860. — DOI:10.1517/14656561003691847. — PMID 20210688.
- ↑ Sacks, SL; Thisted, RA; Jones, TM; Barbarash, RA; Mikolich, DJ; Ruoff, GE; Jorizzo, JL; Gunnill, LB; Katz, D.H. Clinical efficacy of topical docosanol 10% cream for herpes simplex labialis: A multicenter, randomized, placebo-controlled trial (англ.) // Journal of the American Academy of Dermatology (англ.)русск. : journal. — 2001. — Vol. 45, no. 2. — P. 222—230. — DOI:10.1067/mjd.2001.116215. — PMID 11464183.
- ↑ van Diemen F. R., Kruse E. M., Hooykaas M. J., Bruggeling C. E., Schürch A. C., van Ham P. M., Imhof S. M., Nijhuis M., Wiertz E. J., Lebbink R. J. CRISPR/Cas9-Mediated Genome Editing of Herpesviruses Limits Productive and Latent Infections. (англ.) // PLoS pathogens. — 2016. — Vol. 12, no. 6. — P. e1005701. — DOI:10.1371/journal.ppat.1005701. — PMID 27362483.
- ↑ Роман Фишман. Биологи научились очищать клетки от герпесвирусов. nplus1.ru (1 июля 2016). Дата обращения 4 июля 2016.
- ↑ Feedback-mediated signal conversion promotes viral fitness | PNAS
Ссылки[править | править код]
- На Викискладе есть медиафайлы по теме Герпес
Источник

