Неспецифическая реакция на герпес
Роза Исмаиловна Ягудина, д. фарм. н., проф., зав. кафедрой организации лекарственного обеспечения и фармакоэкономики и зав. лабораторией фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова.
Евгения Евгеньевна Аринина, к. м. н., ведущий научный сотрудник лаборатории фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова.
Герпес (herpes simplex) — это хроническое персистирующее заболевание, характеризующееся высыпанием групп пузырьков (везикул) на коже и слизистых оболочках. Его возбудители принадлежат к семейству герпесвирусов (Herpesviridae), которое в свою очередь подразделяется на три подсемейства: α, β и γ. У человека наиболее часто встречаются нейротрофные нейроинвазивные вирусы простого герпеса (ВПГ) двух видов: ВПГ-1 и ВПГ-2, которые относятся к подсемейству α и поражают нервную систему и слизистые оболочки. Они очень эффективно обходят иммунную систему человека, чем можно объяснить длительный скрытый период болезни, позволяющий вирусу максимально распространиться в организме.
ВПГ внедряется в клетки эпителия (слизистой полости рта, глотки или половых органов), где происходит его размножение. Пораженные клетки гибнут, в очаг воспаления мигрируют лимфоциты и макрофаги, происходит выброс биологически активных веществ, повреждение капилляров и соединительной ткани. Затем вирус проникает в чувствительные нервные окончания и по центростремительным нервным волокнам — в паравертебральные ганглии. В ядрах нейронов происходит репликация вируса, цикл репродукции продолжается около 10 часов с образованием в клетке от 50 до 200 тысяч вирионов. При нормальном иммунном ответе через 2–4 недели после заражения происходит разрешение первичного заболевания и элиминация ВПГ из тканей и органов. Однако в паравертебральных ганглиях возбудитель в латентном состоянии сохраняется в течение всей жизни. В любой момент может начаться реактивация размножения ВПГ и его перемещение по нервным волокнам к месту первичного вхождения (воротам инфекции) с рецидивом специфического инфекционно-воспалительного процесса и возможной диссеминацией инфекции.
Причины возникновения и распространение вируса простого герпеса
ВПГ устойчив к действию низких температур: от –20 до –70 °С он сохраняет жизнеспособность 10 и более лет, также как и после лиофильного высушивания. Однако ВПГ не устойчив к нагреванию: при 50–52 °С инактивируется через 30 минут, а при 37 °С — в течение 10 часов. Быстрее всего вирус разрушается под действием ультрафиолетовых и рентгеновских лучей, этилового спирта, эфира и других органических растворителей, протеолитических ферментов. На поверхности кожи и на влажных предметах при комнатной температуре ВПГ сохраняет жизнеспособность в течение 1–4 часов.
Источник распространения вируса герпеса — больные и инфицированные люди. При активной (манифестной) форме он выделяется с кровью, мочой, слюной, другими биологическими жидкостями (содержимое везикул, слезы, менструальная кровь, вагинальное и цервикальное отделяемое, сперма). При латентной форме (вирусоносительстве) ВПГ выделяется таким же образом, но в меньших количествах. Носительство активного вируса чаще всего наблюдается в течение первых 12 месяцев с момента инфицирования. Но при иммунодефицитных состояниях продолжительность этого периода может увеличиваться.
От человека к человеку ВПГ передается разными путями:
- контактно-бытовым;
- половым;
- парентеральным;
- вертикальным (от матери к плоду);
- аэрозольным.
Контактно-бытовой, половой и парентеральный механизмы передачи объединяют в один, называемый «перкутанным».
Наиболее распространена передача ВПГ контактно-бытовым путем — через посуду, предметы личной гигиены, предметы быта, постельное белье, также возможно заражение при поцелуях. В зависимости от механизма передачи вируса выделяют несколько клинических форм этого заболевания. Так, к группе риска при половом и парентеральном способах передачи относятся люди, имеющие беспорядочные половые связи, употребляющие наркотические препараты.
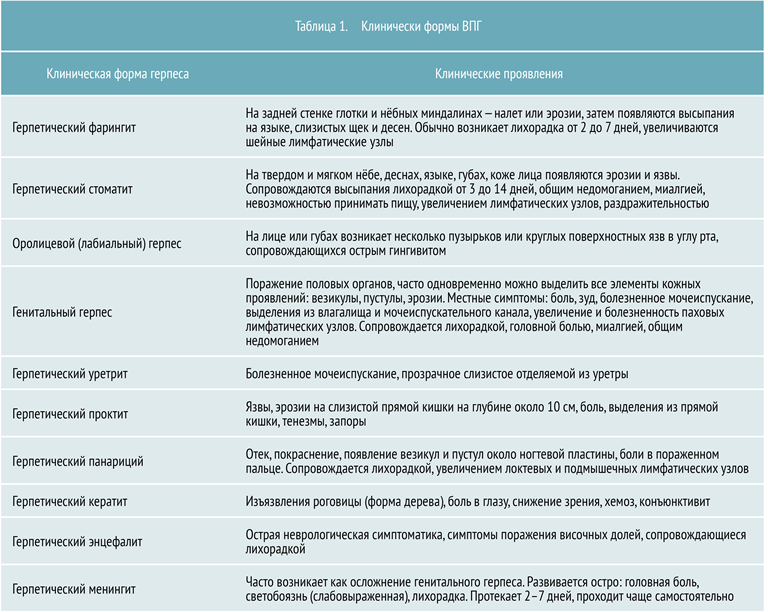
Клиническая картина
В зависимости от участков поражения выделяют несколько клинических форм ВПГ, представленных в таблице 1.
Первичный и вторичный герпес
Заболевание может протекать в следующих формах:
- Герпес первичный
- Герпес рецидивирующий
Первичный герпес чаще всего проявляется стоматитом или фарингитом, в основном у детей и молодых людей. Его инкубационный период составляет в среднем около недели. Общие признаки для всех клинических форм ВПГ: лихорадка, озноб, увеличение регионарных лимфоузлов.
У новорожденных ВПГ протекает в виде острого гингивостоматита, сопровождающегося эрозиями, язвами, некрозом на фоне отека и гиперемии слизистых оболочек.
Факторы риска при рецидивирующей форме герпеса: повышенное физическое или эмоциональное напряжения, общее истощение организма, различные виды лихорадки, травмы, гормональные изменения, поражение кожных покровов, хронические заболевания, переохлаждение, употребление алкоголя и наркотических препаратов, беспорядочная половая жизнь. При рецидиве вирус, находящийся в латентной стадии, активируется. В результате множество вирионов продвигаются по отросткам нейрона и переходят в эпителий кожи и слизистых оболочек. Рецидивирующий герпес развивается на фоне ограниченной гиперемии, с появлением пузырьков, содержащих прозрачный экссудат. Пузырьки обычно располагаются группами, в местах первичного поражения, там же обычно возникают жжение, покалывание и болезненность. Общее состояние человека при этом обычно не изменяется, но иногда может повышаться температура. Содержимое пузырьков может ссыхаться в корку, которая затем отпадает, или пузырьки вскрываются, образуя эрозию. В среднем рецидив герпеса клинически длится около 1–1,5 недели.
После первичного заражения ВПГ навсегда встраивается в геном клетки-хозяина и никогда не элиминируется иммунной системой.
ВПГ имеет циклическую активность (в течение 2–21 дня формируются пузырьки с вирусными частицами), периоды ремиссии, во время которых язвочки пропадают. Цикл репродукции вируса составляет 10 часов. Постепенно у человека формируется противовирусный иммунитет, и частота и тяжесть рецидивов уменьшается.
Формы и симптомы вируса герпеса 1 и 2 типа

Диагностика вируса герпеса: симптомы и лабораторные исследования
Диагностика ВПГ складывается из данных клинического осмотра и результатов лабораторных исследований, особенно значимых при латентной форме.
Оральный (лабиальный) герпес легко диагностируется лишь при наличии внешних проявлений — везикул, ран или язв. На ранних стадиях, когда симптомы заболевания отсутствуют, диагностировать герпес можно только лабораторными методами, который подтверждается при выделении вируса в культуре клеток и четырехкратном повышении титра антител при активной форме заболевания.
Для подтверждения диагноза и выбора терапии используется цитологический метод (в соскобах со дна везикул, окрашенных по Райту, Романовскому — Гимзе, видны характерные для герпеса гигантские клетки с внутриядерными включениями). Однако этот метод малочувствителен и не позволяет, например, отличить ВПГ от опоясывающего лишая.
Серологический метод с IgM и иммуноточечным гликопротеином G-специфичному HSV-тесту даёт более чем 98‑процентную специфичность и позволяет, таким образом, различить HSV-1 и HSV-2 типы герпеса.
Фармакотерапия: как вылечить герпес
В настоящее время существуют два основных направления в лечении вируса простого герпеса в организме человека:
- противовирусная терапия
- комплексная — иммунотерапия (специфическая + неспецифическая) + противовирусная
Противовирусная фармакотерапия
Ацикловир — противовирусный (противогерпетический) препарат, синтетический аналог нуклеозида тимидина, обладающий высокоизбирательным действием на вирусы герпеса. Внутри инфицированных клеток под действием вирусной тимидинкиназы проходит ряд последовательных реакций трансформации ацикловира в моно-, ди- и трифосфат ацикловира. Ацикловир трифосфат встраивается в цепочку вирусной ДНК и блокирует ее синтез посредством конкурентного ингибирования вирусной ДНК-полимеразы.
Специфичность и весьма высокая селективность действия также обусловлены его преимущественным накоплением в клетках, пораженных вирусом. Эффективен для большинства видов ВПГ, но лучший эффект достигается в лечении инфекций, вызванных herpes simplex типов 1 и 2, varicella zoster, слабее влияет на вирус Эпштейна — Барр и цитомегаловирусы.
После приема внутрь биологическая доступность ацикловира составляет 15–30 %, при этом создаются дозозависимые концентрации, достаточные для эффективного лечения вирусных заболеваний. Хорошо проникает во многие органы, ткани и жидкости организма, проникает через гематоэнцефалический и плацентарный барьеры, накапливается в грудном молоке. Связывание ацикловира с белками плазмы составляет 9–33 % и не зависит от его концентрации в плазме. Пища не оказывает значительного влияния на всасывание. Побочные реакции: тошнота, рвота, диарея, преходящее незначительное повышение активности ферментов печени, небольшое повышение концентрации мочевины и креатинина, гипербилирубинемия, головная боль, головокружение, анафилактические реакции, кожная сыпь, синдром Лайелла, синдром Стивенса — Джонсона, зуд, крапивница, сыпь, в том числе сенсибилизация. Таблетки и инъекционные формы ацикловира противопоказаны детям до 3‑х лет
Валацикловир — хлористоводородная соль L-валилового эфира ацикловира. Это пролекарство в организме абсорбируется из ЖКТ и при «первом прохождении» через кишечник и/или печень вследствие ферментативного гидролиза быстро и почти полностью (99 %) превращается в L-валин и ацикловир, который после фосфорилирования приобретает специфическую активность.
Побочные реакции: тошнота, рвота, гастралгия, снижение аппетита, повышение активности ACT, головокружение, головная боль, утомляемость, почечная недостаточность, микроангиопатия, гемолитическая анемия. Не зависит от приема пищи.
Пенцикловир — противовирусный препарат, активен в отношении вирусов herpes simplex 1 и 2 типа и varicella zoster. Пенцикловир попадает в инфицированные вирусом клетки, где под действием вирусной тимидинкиназы быстро превращается в монофосфат, который в свою очередь при участии клеточных ферментов переходит в трифосфат. Пенцикловира трифосфат находится в инфицированных вирусами клетках более 12 часов, подавляя в них синтез вирусной ДНК (дезоксирибонуклеиновой кислоты) и репликацию вирусов. Биодоступность пенцикловира — 77 %.
Побочные реакции: возможны жжение, пощипывание или онемение сразу же после нанесения препарата.
Фамцикловир — после приема внутрь фамцикловир быстро и почти полностью всасывается и превращается в активный пенцикловир.
Побочные реакции: головная боль, головокружение, повышение концентрации билирубина и активности «печеночных» трансаминаз, тошнота, рвота, диарея, боль в животе, кожная сыпь, зуд, повышенная потливость.
Ганцикловир — синтетический аналог 2′-дезоксигуанозина, который подавляет размножение вирусов герпеса. Активен в отношении цитомегаловируса человека (ЦМВ), вирусов простого герпеса 1‑го и 2‑го типа, вирусов герпеса человека 6, 7 и 8 типа, Эпштейна — Барр, ветряной оспы и гепатита В. В инфицированных клетках под действием вирусной протеинкиназы UL97 ганцикловир вначале фосфорилируется с образованием ганцикловира монофосфата, под действием клеточных киназ переходит в трифосфат, а затем подвергается медленному внутриклеточному метаболизму. Так как фосфорилирование ганцикловира в большой степени зависит от действия вирусной киназы, оно происходит преимущественно в инфицированных клетках. Рекомендуется принимать во время еды.
Валганцикловир — L-валиловый эфир (пролекарство) ганцикловира, после приема внутрь быстро превращающийся в ганцикловир под действием кишечных и печеночных эстераз. Рекомендуется принимать во время еды.
Все перечисленные выше препараты — средства «скорой помощи» при любых формах герпеса.
Иммунотерапия простого герпеса
Нарушение иммунного ответа — одно из важнейших звеньев в патогенезе простого герпеса, так как часто заболевание протекает на фоне подавления иммунных реакций. Происходит снижение общего количества Т- и В-клеток, изменение их функциональной активности, наблюдаются нарушения в макрофагальном звене иммунитета, в системе интерферона.
Неспецифическая иммунотерапия включает в себя использование:
- иммуноглобулина;
- интерферонов и индукторов интерферона;
- препаратов, стимулирующих Т- и В-звенья клеточного иммунитета и фагоцитоз.
Механизм действия иммуноглобулинов при герпесе длительное время объясняли заместительным эффектом на фоне присущей этому заболеванию несостоятельности гуморального иммунитета. В последние годы было установлено, что препараты иммуноглобулинов обладают также иммуномодулирующим и антитоксическим действием, активируют опсоно-фагоцитарные реакции.
Для лечения рецидивирующего герпеса применяют иммуноглобулин человеческий нормальный. Препарат содержит достаточное для достижения терапевтического эффекта количество специфических противогерпетических антител.
Интерферон (ИФ) — фактор естественного иммунитета, продуцируется клетками в ответ на воздействие вирусов, бактерий, чужеродных антигенов и активирует реакцию элиминации возбудителей инфекции. Помимо противовирусной активности интерферон обладает антипролиферативным и иммунорегулирующим действием. ИФ повышает неспецифическую резистентность клеток (стимулирует фагоцитоз, увеличивает активность естественных киллеров). Широкий спектр противовирусной активности, отсутствие резистентных к интерферону штаммов вирусов предопределили перспективу его использования как средства этиопатогенетической терапии простого герпеса.
Для лечения различных форм рецидивирующего герпеса используются рекомбинантный альфа-2а интерферон и созданный комбинированный препарат, который состоит из иммуноглобулинов и рекомбинантного альфа-2а интерферона в виде суппозиториев для ректального и вагинального введения.
С помощью препаратов интерферона (природных или генно-инженерных) осуществляется заместительная терапия, в результате чего может блокироваться продукция собственного эндогенного ИФ пациента. Это необходимо принимать во внимание при назначении длительных (более двух недель) курсов ИФ-терапии, особенно генно-инженерных форм. В случаях длительного назначения больным ИФ отменять их следует постепенно, снижая частоту приема до трех, далее двух раз в неделю с последующей полной отменой препарата.
Тилорон, тетрагидроксиглюкопиранозилксантен — индукторы ИФ, стимулируют выработку эндогенного ИФ в организме больного. Это объясняет терапевтический эффект перечисленных препаратов при многих вирусных заболеваниях (рецидивирующем герпесе, гриппе, аденовирусной инфекции), что позволяет рекомендовать их в комплексном лечении всех герпетических заболеваний, особенно у больных, страдающих частыми простудными заболеваниями и ОРВИ.
Специфическая иммунотерапия состоит в применении герпетической вакцины (поливалентной, тканевой, инактивированной). Лечебный эффект вакцины связан со стимуляцией специфических реакций противовирусного иммунитета, восстановлением функциональной активности иммунокомпетентных клеток и специфической десенсибилизацией организма.
Комплексное лечение вируса простого герпеса
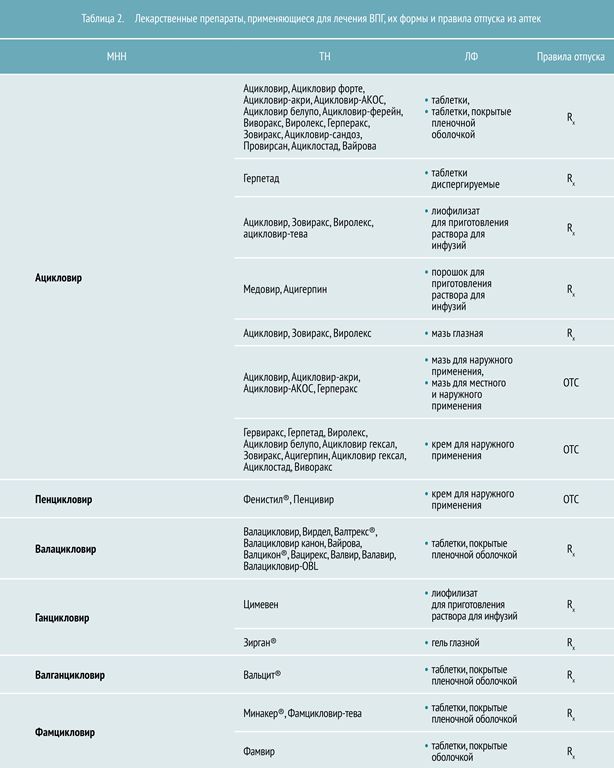
Учитывая патогенез, целесообразно использовать препараты с различным механизмом действия. Это препятствует появлению резистентных штаммов ВПГ, а применение интерферонов и их индукторов в сочетании с герпетической вакциной и иммуномодуляторами позволяет комплексно решать вопросы терапии. В таблице 2 представлены препараты, зарегистрированные на территории РФ для лечения ВПГ.Препараты при лечении вируса герпеса
Источник
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано с их значительной эпидемиологической ролью и социальной значимостью в современном мире. Неуклонный рост числа герпетических заболеваний у взрослых и детей обусловливает необходимость всестороннего изучения герпетической инфекции и разработки эффективных методов профилактики и лечения разнообразных форм этой инфекции. Среди вирусных инфекций герпес занимает одно из ведущих мест в силу повсеместного распространения вирусов, многообразия клинических проявлений, как правило, хронического течения, а также различных путей передачи вирусов.
Он входит в число наиболее распространенных и плохо контролируемых инфекций человека. Герпес-вирусы могут циркулировать в организме с нормальной иммунной системой бессимптомно, но у людей с иммуносупрессией вызывают тяжелые заболевания со смертельным исходом. По данным ВОЗ, смертность от герпетической инфекции среди вирусных заболеваний находится на втором месте (15,8%) после гепатита (35,8%).
Герпес-вирусы объединены в обширное семейство Herpesviridae и в настоящее время наиболее четко классифицированы. Семейство Herpesviridae включает в себя более 80 представителей, 8 из которых для человека наиболее патогенны (human herpes virus-HHV). Герпес-вирусы — филогенетически древнее семейство крупных ДНК-вирусов — подразделяются на 3 подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: α, β и γ (табл. 1, по данным Н. Г. Перминова, И. В. Тимофеева и др., Государственный научный центр вирусологии и биотехнологий).
α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV, характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпес-вирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в ганглиях.
β-герпес-вирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму, в культуре клеток легко возникает персистентная инфекция. К этой группе относятся CMV, HHV-6, HHV-7.
γ-герпес-вирусы характеризуются тропностью к лимфоидным клеткам (Т- и В-лимфоцитам), в которых они длительно персистируют и которые могут трансформировать, вызывая лимфомы, саркомы. В эту группу входят вирус Эпштейна-Барр и HHV-8-герпес — вирус, ассоциированный с саркомой Капоши (KSHV). KSHV является наиболее близким по геномной организации Т-клеточно-тропному обезьяньему герпес-вирусу Саймири (HVS).
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере, EBV и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека.
Клонирование герпес-вирусов происходит по следующей схеме: спонтанная случайная адсорбция исходного «материнского» вируса на поверхности клетки-мишени, «раздевание вириона» — расщепление оболочки и капсида, инфильтрация вирусной ДНК в ядро клетки-мишени, формирование и созревание «дочерних» вирионов путем почкования на ядерной мембране. После инфицирования клетки, например вирусом простого герпеса 1 или 2 типов, синтез новых вирусных белков начинается через 2 ч, а число их достигает максимума примерно через 8 ч. В процессе созревания «дочерних» вирионов их оболочки капсиды и ДНК формируются из имеющихся внутри инфицированной клетки аминокислот, белков, липопротеидов и нуклеозидов. Эти молекулы поступают в инфицированную клетку из межтканевых пространств по мере истощения внутриклеточных резервов. В этом отношении вирусы зависят от интенсивности внутриклеточного обмена, который, в свою очередь, определяется природой клетки-мишени. Наиболее высокий темп обмена веществ характерен для короткоживущих клеток эпителиоидного типа, поэтому герпес- вирусы особенно хорошо колонизируют клетки эпителия и слизистых оболочек, крови и лимфатических тканей. Полностью сформированные и готовые к последующей активной репродукции «дочерние» инфекционные вирионы появляются внутри инфицированной клетки через 10 ч, а их число становится максимальным примерно через 15 ч. Количество вирионов в определенной степени влияет на темп распространения инфекции и площадь поражения.
Первая генерация «дочерних» герпес-вирусов начинает поступать в окружающую среду (межклеточные пространства, кровь, лимфу и другие биологические среды) примерно через 18 ч. Это можно пронаблюдать в клинической практике при неконтролируемых процессах (например, при ветряной оспе, опоясывающем герпесе, генерализации цитомегаловирусной инфекции) — элементы герпетической сыпи возникают на коже или слизистых оболочках волнами. В свободном состоянии герпес-вирусы находятся в течение весьма непродолжительного периода (от 1 до 4 ч) — именно такая продолжительность характерна для периода острой интоксикации при герпес-вирусных инфекциях. Срок жизни каждой генерации образовавшихся и адсорбированных герпес-вирусов в среднем составляет 3 сут.
В эпидемиологическом плане наиболее интересны следующие сведения о герпес-вирусах: вирионы чрезвычайно термолабильны — инактивируются при температуре 50–52°С в течение 30 мин, при температуре 37,5°С — в течение 20 ч, устойчивы при температуре 70°С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50-процентном растворе глицерина. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, во влажных медицинских вате и марле — до их высыхания при комнатной температуре (до 6 ч).
Уникальными биологическими свойствами всех герпес-вирусов человека является тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой способность герпес-вирусов непрерывно или циклично размножаться (реплицироваться) в инфицированных клетках тропных тканей, что создает постоянную угрозу развития инфекционного процесса. Латенция герпес-вирусов — это пожизненное сохранение вирусов в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения герпес-вируса) ганглиев чувствительных нервов. Штаммы герпес-вирусов обладают неодинаковой способностью к персистенции и латенции и чувствительностью к противогерпетическим препаратам в связи с особенностями их ферментных систем. У каждого герпес-вируса свой темп персистенции и латенции. Среди изучаемых наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна-Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, Эпштейна-Барр, герпеса человека 6 и 8 типов). В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путем, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т. п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции.
Герпес-вирусные инфекции широко распространены в мире и имеют тенденцию к неуклонному росту. Особенностью герпес-вирусной инфекции является возможность вовлечения в инфекционный процесс многих органов и систем, чем и обусловлено многообразие вызываемых герпес-вирусами заболеваний, варьирующих от простых кожно-слизистых до угрожающих жизни генерализованных инфекций. Важное свойство герпес-вирусов — это способность после первичного инфицирования в детском возрасте пожизненно персистировать в организме и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов.
Инфицирование человека указанными герпес-вирусами сопровождается клиническими симптомами соответствующего острого инфекционного заболевания в среднем не более чем у 50% людей, в основном у детей: внезапная эритема (вирус герпеса человека 6 типа), афтозный стоматит (вирусы простого герпеса 1 или 2 типов), ветряная оспа (вирус варицелла зостер), инфекционный мононуклеоз (вирус Эпштейна-Барр), мононуклеозоподобный синдром (цитомегаловирус). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпес-вируса, влияние на течение острых и рецидивирующих герпес-вирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онкогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
Часто, особенно при снижении иммунореактивности организма, герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому, с необычными клиническими проявлениями, течению основного заболевания. Вирусы простого герпеса 1 и 2 типов, а также ЦМВ входят в число возбудителей TORCH-инфекций. Они играют важную роль в нарушении репродуктивной функции человека, развитии серьезных заболеваний матери, плода, новорожденного и детей младшего возраста.
Вызываемые вирусами ВПГ, CMV, ВЭБ заболевания рассматриваются как СПИД-индикаторные в связи с их частым обнаружением при данной патологии. В 1988 г. они включены в расширенное определение случаев, подлежащих эпидемиологическому надзору по поводу СПИДа. Результаты исследований последних лет свидетельствуют о роли некоторых герпес-вирусов (ВГЧ-8, ЦМВ, ВЭБ и др.) в развитии ряда злокачественных новообразований: назофарингеальной карциномы, лимфомы Беркитта, В-клеточной лимфомы, рака груди, аденокарциномы кишечника и простаты, карциномы цервикального канала шейки матки, саркомы Капоши, нейробластомы и др.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации — 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес.
По-видимому, все известные герпес-вирусные инфекции могут рецидивировать, однако порог и причины трансформации острой формы в рецидивирующую для каждого типа герпес-вируса свои. В целом герпес-вирусные инфекции принимают рецидивирующее течение не более чем у 8–20% больных. Рецидивирующие герпес-вирусные заболевания у некоторых людей могут восприниматься как «хронические», когда они развиваются в течение многих лет, не только разрушая физическое здоровье и функции жизненно важных систем, но и психологически крайне неблагоприятно влияя на больного. Поэтому для практических целей герпес–вирусные инфекции классифицируют с учетом одновременно локализации процесса, рецидивирования и этиологии (табл. 2).
Причины рецидивирующего течения герпес-вирусных инфекций многообразны. Одна из них заключается в том, что трансформация острого герпес-вирусного процесса в хронический происходит при явном «попустительстве» иммунной системы. Если приобретенный иммунодефицит в результате химиотерапии или ВИЧ-инфекции легко объясним, то все попытки выяснить, чем обусловлен основной дефект иммунного ответа у иммунологически полноценных людей с рецидивирующим течением герпес-вирусной инфекции, оказались безуспешными. Другая причина заключается, по-видимому, в количественной и качественной особенности персистенции и латенции конкретного штамма герпес-вируса в организме больного.
Диагностика герпетической инфекции
Все методы индикации и идентификации вирусов основаны на следующих принципах:
- выявление вируса per se (электронная микроскопия);
- выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках);
- выявление и идентификация вирусов с помощью антител (МФА, ИФА, РАЛ, ИБ, РН, РСК);
- выявление и идентификация нуклеиновых кислот (ПЦР, МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить ГВ или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит
в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпес-вирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке.
Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ.
Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из различных клеточных культур.
Для обнаружения вируса герпеса используют молекулярно-биологические методы: полимеразную цепную реакцию и реакцию молекулярной гибридизации, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение герпетической инфекции
Лечение герпетической инфекции до настоящего времени остается сложной задачей. Хроническое течение процесса приводит к иммунной перестройке организма: развитию вторичной иммунной недостаточности, угнетению реакции клеточного иммунитета, снижению неспецифической защиты организма. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения герпетической инфекции, лекарственных средств, обеспечивающих полное излечение от герпеса, не существует. Герпес-вирусная инфекция относится к трудно контролируемым заболеваниям. Это связано, в первую очередь, с разнообразием клинических поражений, развитием резистентности вируса к лекарственным средствам, наличием у герпес-вирусов молекулярной мимикрии. Поэтому для успешного лечения герпетической инфекции необходимо правильно подобрать противовирусный препарат, его дозу и длительность лечения, использовать комбинацию различных лекарств. В схемы терапии для повышения эффективности лечения необходимо также включать иммунобиологические препараты, способствующие коррекции иммунного статуса, а также патогенетические средства, облегчающие состояние пациента.
В настоящее время все антигерпетические средства подразделяются на 3 основные группы антивирусных препаратов (табл. 3).
Механизм действия химиопрепаратов (аномальных нуклеозидов: валтрекса, вектавира, фамвира, цимевена) связан с угнетением синтеза вирусной ДНК и репликации вирусов путем конкурентного ингибирования вирусной ДНК-полимеразы.
В препаратах-иммуномодуляторах (алпизарин, имунофан, ликопид, полиоксидоний) активно действующие вещества обладают иммуностимулирующими свойствами в отношении клеточного и гуморального иммунитетов, окислительно-восстановительных процессов, синтеза цитокинов.
Препараты-индукторы ИФН (амиксин, неовир, циклоферон) сочетают этиотропный и иммуномодулирующий эффекты действия. Препараты индуцируют образование эндогенных ИФН (α, β, γ) Т- и В-лимфоцитами, энтероцитами, гепатоцитами.
Особое место среди средств антигерпес-вирусной терапии занимает герпетическая вакцина для активации клеточного иммунитета, его иммунокоррекции в фазе ремиссии. Вакцинация преследует 2 цели: предупреждение первичной инфекции и возникновения состояния латентности, а также предупреждение или облегчение течения заболевания.
Однако, несмотря на наличие обширного списка антигерпетических препаратов, герпес остается до сих пор плохо контролируемой инфекцией. Это обусловлено и генотипическими особенностями возбудителя, и длительной персистенцией вируса в организме, и формированием штаммов, устойчивых к антивирусным препаратам. Максимальный клинический эффект может быть получен только при рациональной комплексной терапии лекарственных средств с различным механизмом действия.
Санкт-Петербургской группой ученых вирусологов и инфекционистов во главе с В. А. Исаковым предложена программа лечения и профилактики герпетической инфекции (табл. 4).
| Таблица 4. Принципы этапного лечения и профилактики герпетической инфекции |
Преимущества комплексной терапии ГИ.
- Сочетанное применение противогерпетических химиопрепаратов и иммунобиологических средств обеспечивает синергидный эффект.
- Благодаря снижению дозы противовирусного ХПП уменьшается вероятность развития побочных эффектов, сокращается токсическое воздействие на организм больного.
- Снижается вероятность возникновения устойчивых штаммов герпес-вирусов к данному препарату.
- Достигается иммунокорригирующий эффект.
- Сокращается продолжительность острого периода болезни и сроков лечения.
Таким образом, терапия ГИ является сложной и многокомпонентной задачей.
По вопросам литературы обращайтесь в редакцию.
Т. К. Кускова, кандидат медицинских наук
Е. Г. Белова, кандидат медицинских наук
МГМСУ, Москва
Источник

