Простой герпес лабораторная диагностика
Тема:
Лабораторная диагностика
герпесвирусных инфекций.
Цель:
Изучение лабораторной диагностики
герпесвирусных инфекций.
Модуль
3. Общая и специальная вирусология.
Содержательный
модуль 16. Специальная вирусология.
Тема 6: Лабораторная диагностика герпесвирусных инфекций.
А ктуальность
ктуальность
темы:
Вирус простого
герпеса – одна из самых распространенных
вирусных инфекций человека, характеризующаяся
лихорадочным состоянием и пузырьковыми
высыпаниями, которые чаще всего
локализуются на коже и слизистых
оболочках. Важными особенностями
герпетической инфекции являются
пожизненное носительство вируса и
частые рецидивы болезни.
Вирусная
природа простого герпеса установлена
в 1912 г. У. Грютером.
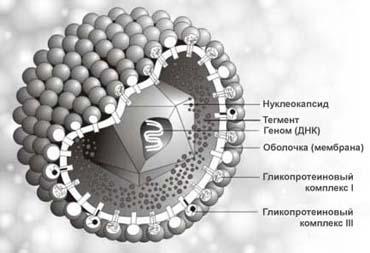
(Трёхмерное
изображение вируса герпеса).
Герпесвирусы и вызываемые ими заболевания
Типы | Вызываемые |
ВПГ-1 | Поражение: |
ВПГ-2 | Поражение |
ВЗВ | Ветряная |
ЦМВ | Патологии |
ВЭБ | Инфекционный |
ВГ-6 | Вирус, |
ВГ-7 | Вирус, |
ВГ-8 | Вирус, |
Примечание. | |
Таксономия,
морфология, химический состав.
Возбудитель простого герпеса —
ДНК-содержащий вирус, относится к
семейству Herpesviridae, роду Simplexvirus. По
морфологии и химическому составу не
отличается от вирусов ветряной оспы и
опоясывающего герпеса.
К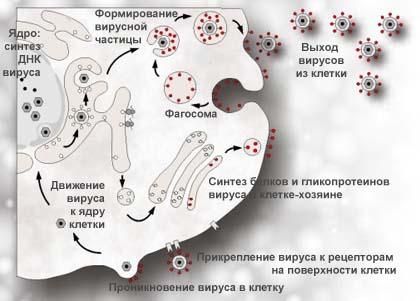 ультивирование.Вирус простого герпеса (ВПГ) культивируют
ультивирование.Вирус простого герпеса (ВПГ) культивируют
в куриных эмбрионах, культурах клеток
и организме лабораторных животных. На
хорионаллантоисной оболочке куриных
эмбрионов вирус образует мелкие белые
плотные узелки-бляшки; в зараженных
культурах — вызывает цитопатический
эффект: образование гигантских
многоядерных клеток с внутриядерными
включениями.
Антигенная
структура.
Вирус содержит ряд антигенов, связанных
как с внутренними белками, так и с
гликопротеидами наружной оболочки.
Последние являются основными иммуногенами,
индуцирующими выработку антител и
клеточный иммунитет. Существует два
серотипа вируса: ВПГ типа 1 и ВПГ типа
2.
Резистентность.
Вирус может выживать на поверхности
предметов при комнатной температуре в
течение нескольких часов, чувствителен
к УФ-лучам, обычным дезинфицирующим
средствам, жирорастворителям, термолабилен.
Восприимчивость
животных.
Вирус простого герпеса патогенен для
многих животных, у которых вызывает
энцефалит при введении возбудителя в
мозг или местный воспалительный процесс
при заражении в глаз. В естественных
условиях животные не болеют.
Эпидемиология.
Простой герпес — одна из самых
распространенных инфекций, которая
поражает различные возрастные группы
людей, чаще в осенне-зимний период.
Отмечаются спорадические случаи
заболевания, иногда небольшие вспышки
в семьях, детских коллективах, больницах.
Эпидемий не наблюдается.
Источником
инфекции
являются больные и носители. Основной
механизм передачи
— контактный, аэрогенный. Заражение
происходит при попадании вирусов на
поврежденные кожные покровы или слизистые
оболочки.
Эпидемиология
герпеса, вызванного вирусами типов 1 и
2, различна. ВПГ типа 1 передается через
слюну, зараженные слюной руки и предметы
быта, а ВПГ типа 2 — половым путем. Возможно
заражение плода через плаценту.
Патогенез
и клиническая картина.
По клиническим проявлениям различают
первичный и рецидивирующий герпес.
Входными воротами возбудителя при
первичной герпетической инфекции
являются поврежденные участки кожи и
слизистых оболочек рта, глаз, носа,
мочеполового тракта, где вирусы
репродуцируются. Затем по лимфатическим
сосудам вирусы попадают в кровь и
заносятся в различные органы и ткани.
Инкубационный
период
при первичном герпесе составляет в
среднем 6-7 дней. Заболевание начинается
с жжения, зуда, покраснения, отека на
ограниченных участках кожи и слизистых
оболочек, затем на этом месте появляются
пузырьковые высыпания, наполненные
жидкостью. Иногда заболевание
сопровождается повышением температуры
тела и нарушением общего состояния. При
подсыхании пузырьков рубцов не образуется.
Первичный герпес у новорожденных
протекает тяжело и нередко заканчивается
смертью. Однако у большинства людей
первичная инфекция остается нераспознанной,
так как протекает бессимптомно.
После
первичной инфекции (явной и бессимптомной)
70-90 % людей остаются пожизненными
носителями вируса, который сохраняется
в латентном состоянии в нервных клетках
чувствительных ганглиев. Нередко у
носителей появляются рецидивы болезни
в результате переохлаждения, перегревания,
менструации, интоксикации, различных
инфекционных заболеваний, стрессов,
нервно-психических расстройств. Для
рецидивирующего герпеса характерны
повторные высыпания на коже и слизистых
оболочках, нередко в тех же местах.
Наиболее частой локализацией
рецидивирующего герпеса, вызванного
ВПГ типа 1, являются губы, крылья носа,
полость рта, конъюнктива глаз. ВПГ типа
2 поражает мочеполовую систему и вызывает
герпес новорожденных. Доказана роль
ВПГ типа 2 в развитии рака шейки матки.
Сравнительно редко встречаются
генерализованные формы рецидивирующего
герпеса, в частности поражения нервной
системы и внутренних органов.
Иммунитет.
В результате первичной герпетической
инфекции в организме образуются
сывороточные и секреторные антитела,
которые обусловливают иммунитет к
первичному герпесу, но не препятствуют
сохранению вируса и возникновению
рецидивов. Рецидивирующий герпес
возникает при высоком уровне антител
к вирусу герпеса. Основное значение в
развитии рецидивирующего герпеса имеет
состояние клеточного иммунитета.
Лабораторная
диагностика.
Материалом для исследования являются
содержимое герпетических пузырьков,
слюна, соскобы с роговой оболочки глаза,
кровь, цереброспинальная жидкость, в
летальных случаях . кусочки головного
и спинного мозга.
Экспресс-диагностика
заключается в обнаружении гигантских
многоядерных клеток с внутриядерными
включениями в мазках-отпечатках из
высыпаний, окрашенных по Романовскому-Гимзе.
Для дифференциации от других вирусов,
принадлежащих к этому семейству,
используют РИФ, ИФА, РИА, ПЦР. Выделение
вируса проводят на куриных эмбрионах,
культуре клеток и на лабораторных
животных (мыши-сосунки), идентифицируют
вирус с помощью РИФ или РН. В последние
годы в диагностике простого герпеса
начали применять моноклональные
антитела, что дает возможность определить
серотип вируса. Для серодиагностики
заболевания используют РСК, РН, РИФ,
ИФА.
Специфическая
профилактика и лечение.
Для профилактики тяжелых форм
рецидивирующего герпеса в период
ремиссии применяют многократное введение
инактивированной, культуральной
герпетической вакцины. Вакцинация, а
также применение иммуномодуляторов,
например реаферона, удлиняют межрецидивный
период и облегчают течение последующих
рецидивов. В остром периоде с лечебной
целью используют химиотерапевтические
препараты (виразол, ацикловир, оксолиновую,
тебро-феновую, флореналовую мази,
бонафтон), интерфероны и индукторы
интерферона.
Вирус
цитомегалии
Ц итомегалия— инфекционное заболевание, возбудителем
итомегалия— инфекционное заболевание, возбудителем
которого является цитомегаловирус
(ЦМВ)Cytomegalovirus hominis (от
греч. cytys — клетка, megas — большой). Вирус
вызывает цитомегаловирусную инфекцию
человека, характеризующуюся поражением
почти всех органов (преимущественно
слюнных желез) с образованием в них
гигантских клеток с внутриядерными
включениями, протекающую в различных
формах — от бессимптомного носительства
до тяжелой генерализованной формы,
заканчивающейся летальным исходом.
Вирус впервые
выделен К. Смитом в 1956 г.
Таксономия,
морфология, антигенная структура.Возбудитель цитомегалии — ДНК-содержащий
вирус, относится к семейству Herpesviridae,
роду Cytomegalovirus.
Морфология,
химический составтипичны для семейства
герпесвирусов. Диаметр вирусной частицы
(вириона) около 180 нм. В центре вириона
находится двенадцатигранный нуклеокапсид,
содержащий генетическую информацию —
двухнитевую ДНК-вируса. Установлено 2
антигенных серотипа вируса.
Культивирование.Цитомегаловирус репродуцируется в
ограниченном числе первичных и
перевиваемых клеточных культур, вызывая
характерный цитопатический эффект —
образование гигантских («цитомегаловирусных»)
клеток с внутриядерными включениями.
Вирус патогенен для обезьян.
Резистентность.Вирус термолабилен, чувствителен к
дезинфицирующим средствам и
жирорастворителям.
Эпидемиология.Цитомегаловирусная инфекция широко
распространена на земном шаре. Источником
вируса является больной человек или
носитель. Вирус выделяется со слюной,
мочой, секретами организма, реже
фекалиями. Предполагается, чтоведущий
механизм передачи инфекции—
контактно-бытовой, возможны аэрогенный
и фекально-оральный механизмы передачи.
Цитомегаловирус обладает высокой
способностью проникать через плаценту
(вертикальная передача), вызывая
внутриутробную патологию плода.
Патогенез и
клиническая картина.Патогенез не
вполне выяснен. Инфекция связана с
длительным носительством вируса, который
в латентном состоянии сохраняется в
слюнных железах, почках и других органах.
Активация латентной инфекции происходит
при иммунодефицитных состояниях,
иммунодепрессивной терапии. Вирус
поражает ЦНС, костный мозг, почки, печень,
клетки крови. У беременных женщин
цитомегалия может приводить к
недоношенности, мертворождению, развитию
аномалий у плода.
Иммунитет.У
больных независимо от клинической формы
инфекции, а также у носителей образуются
антитела, которые, однако, не препятствуют
сохранению вируса в организме и выделению
его в окружающую среду. Интенсивность
развития болезни находится под контролем
клеточной иммунной системы хозяина.
Лабораторная
диагностика.Обследованию на цитомегалию
в первую очередь подлежат дети с
поражением ЦНС и врожденными уродствами,
а также женщины с неблагополучно
протекающей беременностью.Исследуемый
материал— слюна, моча, мокрота,
цереброспинальная жидкость, кровь,
пунктат печени.
Диагностика
основана на выявлении в исследуемом
материале под микроскопом «цитомегалических»
клеток, а также обнаружении антител
класса IgM с помощью РИФ, ИФА, РИА. Вирус
выделяют в культуре клеток, идентифицируют
по морфологическим изменениям зараженных
клеток и с помощью РН. Экспресс-диагностика
— РИФ с моноклональными антителами.
Применяют также методы генодиагностики:
ПЦР и гибридизацию.
Специфическая
профилактика и лечение.Разработана
живая аттенуированная вакцина. Для
лечения применяют химиотерапевтические
препараты (ганцикловир, фоскорнет
натрия), иммуномодуляторы, интерферон.
Источник
… согласно данным серологического обследования около 90% всего населения планеты инфицировано одним или несколькими серотипами вируса простого герпеса.
Введение. Герпесвирусы широко распространены в человеческой популяции, они пантропны, способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции. В настоящее время известно 8 антигенных серотипов вирусов герпеса: вирусы простого герпеса 1-го и 2-го типа, ветряной оспы (опоясывающего герпеса), цитомегаловирус, вирус Эпштейна-Барра, вирусы герпеса человека 6, 7 и 8-го типов.
(1) Вирус простого герпеса 1-го типа (ВПГ-1) ассоциирован с лабиальным герпесом, герпесом кожи и слизистых оболочек, офтальмогерпесом, пневмонитами, генитальным герпесом, герпетическим энцефалитом.
(2) Вирус простого герпеса 2-го типа (ВПГ-2) ассоциирован с генитальным герпесом и неонатальным герпесом.
(3) Вирус ветряной оспы (опоясывающего герпеса, ВВО-ОГ) ассоциирован с ветряной оспой и опоясывающим герпесом.
(4) Вирус Эпштейна-Барра (ВЭБ) ассоциирован с назофарингиальной карциномой, инфекционным мононуклеозом, лимфомой Беркитта, волосатой лейкоплакией.
(5) Цитомегаловирус (ЦМВ) ассоциирован с врожденными поражениями ЦНС, ретинопатиями, пневмонитами, гепатитами, сиаладенитами.
(6) Вирус герпеса человека 6-го и 7-го типов (ВГЧ-6:ВГЧ-6А, ВГЧ6Б; ВГЧ-7) — лимфотропные вирусы; предполагают этиологическую связь ВГЧ-6Б с внезапной экзантемой, а ВГЧ-7 с синдромом хронической усталости.
(7) Вирус герпеса человека 8-го типа (ВГЧ-8) ассоциирован с саркомой Капоши у ВИЧ-серонегативных людей, саркомой Капоши, ассоциированной с ВИЧ-инфекцией и СПИДом, а также лимфопролиферативными заболеваниями: многоочаговое заболевание Кастлемана, лимфомой первичного экссудата;
Диагностика герпесвирусной инфекции осуществляется с помощью классического вирусовыделения на чувствительных клеточных культурах, иммунофлюоресцентным и серологическим методами, проведением вульвокольпоцервикоскопии, использованием современных молекулярно-биологических методов (ПЦР, ЛЦР, дот-гибридизация), что позволяет диагностировать всю группу герпесвирусов, включая ВГЧ-6, ВГЧ-7 и ВГЧ-8 типы. Многие исследователи подчеркивают важную роль одновременного использования нескольких методов диагностики. В качестве скринингового метода при диагностике герпесвирусной инфекции рекомендуется использовать метод ПЦР, иммуноферментный анализ (ИФА) и реакцию иммунофлюоресценции (РИФ), а в качестве подтверждающего — метод выделения герпесвирусов на чувствительных клеточных культурах. Предлагаются и другие диагностические алгоритмы. (!) Вирусологический метод является «золотым стандартом» в диагностике герпесвирусной инфекции. Отличительной особенностью данного метода является высокая степень достоверности полученных результатов, а также высокая чувствительность (85-100%) и специфичность (100%), возможность получения чистой культуры возбудителя для его дальнейшего изучения, в частности испытания чувствительности к антивирусным препаратам; недостатком — длительность проведения (от 2 до 5-14 дней). Кроме того, этот метод недоступен большинству медицинских учреждений, так как культивирование с использованием клеточных культур является процессом трудоемким, дорогостоящим, а также требующим (!) высокой квалификации персонала. Чувствительность метода зависит от времени, прошедшего с момента забора материала до посева, от качества забора материала, условий транспортировки, от качества используемых сред и реагентов.
ПЦР-диагностика ВПГ-1,2. (1) В острой фазе вирусы простого герпеса паразитируют в эпителиальных клетках слизистых оболочек и кожи, вызывают типичные (и атипичные) клинические проявления. Среди атипичных возможны бессимптомные формы. При первичной инфекции ВПГ 1, 2 обнаруживается методом ПЦР в пузырьках (или в трещинах при атипичном течении) максимум в течение 7 дней после первых проявлений. У носителей во время рецидивов – до 4-х дней. При сниженном иммунитете – до 21 дня.
Обнаружение вирусов методом ПЦР в пробе соскоба эпителия свидетельствует об острой фазе инфекции. (2) Во время латентной фазы (ремиссии) вирусы простого герпеса персистируют в нервных ганглиях и отсутствуют в эпителиальных клетках, а значит, не выявляются методом ПЦР в соскобе. Клинических проявлений инфекции при этом нет или наблюдаются остаточные проявления (пузырьки могут заселяться неспецифической микрофлорой).
Выводы: таким образом, если вирусы не обнаружили методом ПЦР в соскобе эпителия, то это означает, либо латентную фазу герпесвирусной инфекции, либо отсутствие вирусов в организме. Проверить есть ли носительство можно только с помощью метода ИФА.
ПЦР-диагностика ЦМВ. Биологическим материалом для ПЦР-исследований могут быть: кровь, ликвор, моча, слюна, мокрота, грудное молоко, соскобы (урогенитальные, из зева), сперма, лаваж, биоптаты, в зависимости от формы заболевания. Для беременных адекватной пробой для ПЦР-исследования является соскоб из цервикального канала (при положительном результате – угроза плоду).
ИФА-диагностика ВПГ-1, ВПГ-2 и ЦМВ. Необходимо помнить: исследование сыворотки крови методом иммуноферментного анализа (ИФА) на наличие антител к герпесвирусам поможет установить, есть ли носительство и фазу заболевания (первичный острый процесс, латенция или вторичное обострение, — рецидив).
Первичное заражение. При первичном заражении на 5-7 день вырабатываются IgM, через 10-14 дней – низкоавидные IgG, затем постепенно авидность IgG возрастает и они становятся высокоавидными (термин «авидность» означает степень сродства антител к антигенам и, соответственно, силу связывания антител с антигенами). IgM исчезают через 1 месяц, низкоавидные IgG – через 1-3 месяца, а IgG (поздние, высокоавидные) циркулируют в крови носителя пожизненно. Так как IgM вырабатываются обычно только при первичной инфекции, то и в лабораторной диагностике они являются маркерами первичной герпесвирусной инфекции. Из-за низкой специфичности IgM они могут перекрестно реагировать (с ревматоидным фактором и др.) и вызывать появление ложноположительных результатов. Для исключения ошибки необходимо проверить наличие низкоавидных IgG или повторить исследование IgM через 2 недели (при развитии первичного процесса должны вновь выявиться IgM и появиться низкоавидные IgG). Если низкоавидные IgG не появились, а IgM выявились снова, то этот положительный результат надо считать ложным. Наиболее специфичными маркерами первичной герпесвирусной инфекции являются низкоавидные IgG. Они никогда не вырабатываются при повторном заражении или рецидиве. Тест на авидность IgG дает информацию о том, выявились ли IgG и какие выявились IgG – низкоавидные или высокоавидные. Низкоавидные IgG более специфичные антитела, чем IgM, поэтому при использовании теста на авидность IgG не возникает проблем с ложноположительными результатами.
Рецидив и реинфекция. Активация герпесвирусной инфекции у носителей (рецидивы) и реинфекция сопровождаются: (1) появлением и нарастанием титров IgG к предранним белкам вирусов (всегда), (2) нарастанием в 2-4 раза титра имеющихся поздних, высокоавидных IgG (не всегда). IgG к предранним белкам вирусов вырабатываются в ответ на самое начало развития вирусного цикла в организме человека, на неструктурные предранние белки. Они появляются на 5-7 день активации вирусной инфекции и циркулируют в крови 1-2 месяца после наступления ремиссии. Это очень специфичные антитела, поэтому при их выявлении не возникает ложноположительных результатов. IgG к предранним белкам вирусов являются однозначными маркерами активности вирусной инфекции. Они вырабатываются как при первичной острой инфекции, так и во время рецидива и реинфекции. Количество поздних IgG у носителей может варьировать в зависимости от стадии заболевания, от состояния иммунной системы пациента вообще и на момент обследования в частности. Например, при наличии иммуносупрессии, которую может вызывать длительное течение хронической вирусной инфекции, во время рецидива количество поздних IgG совсем не увеличивается, или увеличивается, но не в 4 раза, как при классическом иммунном ответе на рецидив. Поэтому количественный показатель IgG далеко не всегда обладает диагностической ценностью, даже в динамике.
Выводы. Для вирусоносителей единственный надежный тест для определения активности герпесвирусов это выявление IgG к предранним белкам вирусов (полуколичественно). Появление их в любом титре свидетельствует об активности вирусной инфекции. Увеличение титра через 1-3 недели свидетельствует о развитии рецидива, а уменьшение – о наступлении ремиссии. Выявление поздних IgG при отсутствии IgG к предранним белкам вирусов свидетельствует о спокойном носительстве, латентной фазе. Выявление IgM и низкоавидных IgG, предранних IgG при отсутствии поздних IgG, — свидетельствует о первичном инфекционном процессе. Отсутствие поздних IgG, IgM и IgG к предранним белкам герпесвирусов, то есть серонегативность в отношении данных вирусов, означает отсутствие как носительства, так и развития инфекции.
См. также статью (медицинский портал DoctorSPB.ru, раздел «лабораторная диагностика»): «Лабораторная диагностика ВПГ (вирус простого герпеса)».
Лабораторная диагностика и интерпретация результатов определения в сыворотке крови антител классов М и G к антигенам вируса Эпштейна-Барр (ЕBV/ВЭБ). ВЭБ относится к наиболее распространенным герпесвирусам, носительство в различных регионах достигает 100%. Однако актуальной является лабораторная диагностика данного вируса при дифференциальной диагностике инфекционного мононуклеоза, а также в поисках этиологии некоторых кардиологических, онкологических и др. патологий. Острая фаза мононуклеоза характеризуется выявлением вируса Эпштейна-Барр методом ПЦР из мазка из зева. Однако наиболее точно выяснить стадию заболевания или носительство можно с помощью метода ИФА. В настоящее время различают 3 диагностически значимых антигена ЕBV – ранний (ЕА), капсидный (VСА) и ядерный (ЕВNА). Определяя антитела к данным антигенам, а именно, — (1) IgM, IgG к VCA, (2) IgG к EA и (3) IgG к EBNA, можно диагностировать стадию инфекции EBV: первичную, прошедшую (паст-инфекцию) и реактивацию. Отсутствие инфицирования — VСА: IgM (-) IgG (-); ЕА IgG (-); ЕВNА IgG (-); очень ранняя первичная инфекция — VСА: IgM (+) IgG (-); ЕА IgG (-); ЕВNА IgG (-); ранняя первичная инфекция — VСА: IgM (+) IgG (+); ЕА IgG (+); ЕВNА IgG (-); поздняя первичная инфекция — VСА: IgM (+/-) IgG (+); ЕА IgG (-/+); ЕВNА IgG (+); паст-инфекция — VСА: IgM (-) IgG (+); ЕА IgG (-); ЕВNА IgG (+); реактивация — VСА: IgM (+/-) IgG (+); ЕА IgG (+); ЕВNА IgG (+). Наиболее адекватно эти маркеры выявляются с помощью тест-систем ВСМ производства США (высокая чувствительность и воспроизводимость результатов).
Рекомендуется определение всех упомянутых серологических маркеров в комплексе, так как это повышает вероятность постановки точного диагноза и дает возможность выбора адекватной терапии. Особую трудность представляет диагностика ВЭБ-инфекции у иммуноскомпрометированных пациентов; в этом случае серологический профиль может быть сильно искажен и непоказателен. Для диагностики ВЭБ–инфекции параллельно с определением серологических маркеров целесообразно выявление ДНК возбудителя методом ПЦР в крови или другом биоматериале (мазки из зева при инфекционном мононуклеозе). Для постановки клинического диагноза необходимо сопоставлять результаты серологического тестирования с результатами других анализов, симптоматикой и анамнезом пациента.
См. также статью (медицинский портал DoctorSPB.ru, раздел «лабораторная диагностика»): Лабораторная диагностика инфекции, вызванной вирусом Эпштейн-Барр.
Источник


