Достижения в лечении герпеса
В России разработали ДНК-вакцину от герпеса, с помощью которой можно будет успешно лечить и предупреждать это на вид безобидное, но на самом деле опасное заболевание. Не исключено, что с помощью новой универсальной вакцины удастся не только снизить тяжесть рецидивов, но и полностью излечить человека от герпеса, рассказали «Известиям» в Федеральном медико-биологическом агентстве (ФМБА) России. Ученые рассчитывают, что всеобщая профилактическая вакцинация поможет в будущем искоренить этот вирус, хотя сейчас им поражено подавляющее большинство населения.
ДНК-вакцина от герпеса, разрабатываемая Санкт-Петербургским научно-исследовательским институтом особо чистых биопрепаратов ФМБА России, намного безопаснее существующих, которые содержат ослабленный вирус или его инактивированные компоненты.
— Ослабленный, но, по сути, живой вирус в составе вакцин, применяющихся сейчас для профилактики рецидивов, может иногда привести к развитию энцефалита, утяжелению респираторных заболеваний, вплоть до пневмонии, поражению печени, другим неблагоприятным последствиям, — рассказал «Известиям» научный руководитель Государственного НИИ особо чистых биопрепаратов ФМБА России, член-корреспондент РАН Андрей Симбирцев. — Кроме того, существует несколько типов вируса герпеса, и универсальной вакцины для них до сих пор не создано.
Сейчас в мире применяется и разрабатывается несколько вакцин от герпеса, которые можно использовать для увеличения продолжительности ремиссий и снижения тяжести рецидивов. Каждая из них справляется только с каким-то одним типом этого вируса, поэтому для профилактики герпеса их не применяют.
По словам ученого, новая вакцина — продукт генной инженерии — обеспечивает высокий уровень биобезопасности, потому что содержит только гены фрагментов белков. Наличие в вакцине фрагментов, специфичных для разных типов вируса, защищает человека почти от всех разновидностей этой болезни.
Вакцину можно применять и для взрослых, и для детей. Она будет использоваться как с целью профилактики заболевания, так и для лечения людей, уже инфицированных герпесом.
По словам Андрея Симбирцева, вакцина позволит увеличить интервалы между рецидивами и снизить тяжесть их течения, то есть существенно повысить качество жизни пациента.
— Нельзя исключить и возможность полного выздоровления на фоне применения вакцины, — отметил ученый. — В долгосрочной перспективе всеобщая профилактическая вакцинация может искоренить это заболевание как таковое или снизить его эпидемическую актуальность до минимальных значений.
По оценкам ВОЗ, инфицированность герпесом охватывает до двух третей населения, пояснил «Известиям» руководитель ФМБА России Владимир Уйба.
— Многие даже не подозревают, что они носители вируса. Но это опасная болезнь. При определенных условиях наличие герпеса у человека может привести к отказу иммунитета. Непрерывно рецидивирующая форма течения, с клиническими проявлениями от шести раз в год, встречается у 60% инфицированных и приводит к вторичному иммунодефициту, а это уже риск тяжелых бактериальных инфекций и даже развития онкологии. Универсальная ДНК-вакцина против вируса — это прорыв в лечении заболевания, — рассказал он.
Уже проведены пилотные исследования препарата. Следующий этап — масштабирование технологии и полноценные регистрационные доклинические исследования для получения разрешения на проведение клинических испытаний.
— Доклиника сработала великолепно, и высока вероятность, что клинику мы успешно пройдем и получим универсальную вакцину против герпеса, — добавил руководитель ФМБА России.
Замдиректора Центрального НИИ эпидемиологии Роспотребнадзора Виктор Малеев считает, что важно создать вакцину от герпеса отечественного производства.
— Герпес широко распространен. Это условно-патогенный вирус. Он есть у всех, но не у каждого проявляется, — отметил эксперт. — Сейчас нет отечественных вакцин от герпеса, так что создание собственного препарата необходимо.
Доктор медицинских наук, врач-иммунолог Владислав Жемчугов, напротив, не видит смысла в вакцинации от герпеса. Он пояснил, что вирусов герпеса много, и сделать одинаково эффективную вакцину против всех крайне сложно. К тому же чаще всего вирус активизируется на фоне других заболеваний. Поэтому, чтобы подавить активность герпеса, нужно искать причину и вылечить или компенсировать основной процесс. А им может быть хроническая инфекция вплоть до СПИДа, обменные или гормональные нарушения.
— Вирус опасен для тех, у кого есть нарушения иммунитета. Это, например, люди с хроническими инфекциями, онкологическими заболеваниями, ВИЧ, туберкулезом. Случается, что вирус активизируется у детей, не долеченных от простудных заболеваний. Он может вызвать тяжелейшие повреждения мозга, — рассказал Вячеслав Жемчугов.
Но бывает и так, что сам герпес является причиной заболевания. Например, он может спровоцировать бесплодие, невынашиваемость беременности, инфекционный мононуклеоз и заболевания крови (вирус Эпштейн-Барра — это один из видов герпес-вирусов). В таких случаях рекомендуется медикаментозно подавить его активность (противовирусными средствами) на некоторое время в расчете на то, что дальше организм будет справляться сам.
Ранее структуры ФМБА разработали новую вакцину от гриппа, безвредную для беременных женщин, рассказывал в интервью «Известиям» глава агентства Владимир Уйба.
Источник
Роза Исмаиловна Ягудина, д. фарм. н., проф., зав. кафедрой организации лекарственного обеспечения и фармакоэкономики и зав. лабораторией фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова.
Евгения Евгеньевна Аринина, к. м. н., ведущий научный сотрудник лаборатории фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова.
Герпес (herpes simplex) — это хроническое персистирующее заболевание, характеризующееся высыпанием групп пузырьков (везикул) на коже и слизистых оболочках. Его возбудители принадлежат к семейству герпесвирусов (Herpesviridae), которое в свою очередь подразделяется на три подсемейства: α, β и γ. У человека наиболее часто встречаются нейротрофные нейроинвазивные вирусы простого герпеса (ВПГ) двух видов: ВПГ-1 и ВПГ-2, которые относятся к подсемейству α и поражают нервную систему и слизистые оболочки. Они очень эффективно обходят иммунную систему человека, чем можно объяснить длительный скрытый период болезни, позволяющий вирусу максимально распространиться в организме.
ВПГ внедряется в клетки эпителия (слизистой полости рта, глотки или половых органов), где происходит его размножение. Пораженные клетки гибнут, в очаг воспаления мигрируют лимфоциты и макрофаги, происходит выброс биологически активных веществ, повреждение капилляров и соединительной ткани. Затем вирус проникает в чувствительные нервные окончания и по центростремительным нервным волокнам — в паравертебральные ганглии. В ядрах нейронов происходит репликация вируса, цикл репродукции продолжается около 10 часов с образованием в клетке от 50 до 200 тысяч вирионов. При нормальном иммунном ответе через 2–4 недели после заражения происходит разрешение первичного заболевания и элиминация ВПГ из тканей и органов. Однако в паравертебральных ганглиях возбудитель в латентном состоянии сохраняется в течение всей жизни. В любой момент может начаться реактивация размножения ВПГ и его перемещение по нервным волокнам к месту первичного вхождения (воротам инфекции) с рецидивом специфического инфекционно-воспалительного процесса и возможной диссеминацией инфекции.
Причины возникновения и распространение вируса простого герпеса
ВПГ устойчив к действию низких температур: от –20 до –70 °С он сохраняет жизнеспособность 10 и более лет, также как и после лиофильного высушивания. Однако ВПГ не устойчив к нагреванию: при 50–52 °С инактивируется через 30 минут, а при 37 °С — в течение 10 часов. Быстрее всего вирус разрушается под действием ультрафиолетовых и рентгеновских лучей, этилового спирта, эфира и других органических растворителей, протеолитических ферментов. На поверхности кожи и на влажных предметах при комнатной температуре ВПГ сохраняет жизнеспособность в течение 1–4 часов.
Источник распространения вируса герпеса — больные и инфицированные люди. При активной (манифестной) форме он выделяется с кровью, мочой, слюной, другими биологическими жидкостями (содержимое везикул, слезы, менструальная кровь, вагинальное и цервикальное отделяемое, сперма). При латентной форме (вирусоносительстве) ВПГ выделяется таким же образом, но в меньших количествах. Носительство активного вируса чаще всего наблюдается в течение первых 12 месяцев с момента инфицирования. Но при иммунодефицитных состояниях продолжительность этого периода может увеличиваться.
От человека к человеку ВПГ передается разными путями:
- контактно-бытовым;
- половым;
- парентеральным;
- вертикальным (от матери к плоду);
- аэрозольным.
Контактно-бытовой, половой и парентеральный механизмы передачи объединяют в один, называемый «перкутанным».
Наиболее распространена передача ВПГ контактно-бытовым путем — через посуду, предметы личной гигиены, предметы быта, постельное белье, также возможно заражение при поцелуях. В зависимости от механизма передачи вируса выделяют несколько клинических форм этого заболевания. Так, к группе риска при половом и парентеральном способах передачи относятся люди, имеющие беспорядочные половые связи, употребляющие наркотические препараты.
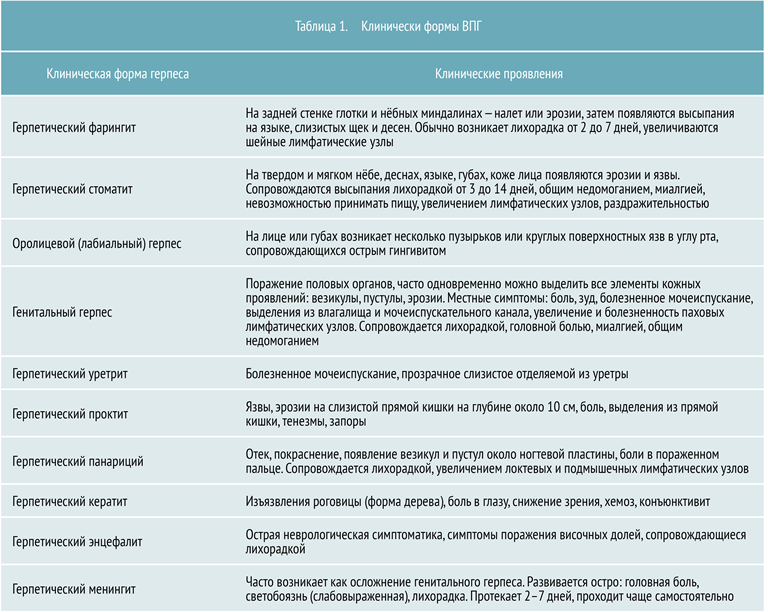
Клиническая картина
В зависимости от участков поражения выделяют несколько клинических форм ВПГ, представленных в таблице 1.
Первичный и вторичный герпес
Заболевание может протекать в следующих формах:
- Герпес первичный
- Герпес рецидивирующий
Первичный герпес чаще всего проявляется стоматитом или фарингитом, в основном у детей и молодых людей. Его инкубационный период составляет в среднем около недели. Общие признаки для всех клинических форм ВПГ: лихорадка, озноб, увеличение регионарных лимфоузлов.
У новорожденных ВПГ протекает в виде острого гингивостоматита, сопровождающегося эрозиями, язвами, некрозом на фоне отека и гиперемии слизистых оболочек.
Факторы риска при рецидивирующей форме герпеса: повышенное физическое или эмоциональное напряжения, общее истощение организма, различные виды лихорадки, травмы, гормональные изменения, поражение кожных покровов, хронические заболевания, переохлаждение, употребление алкоголя и наркотических препаратов, беспорядочная половая жизнь. При рецидиве вирус, находящийся в латентной стадии, активируется. В результате множество вирионов продвигаются по отросткам нейрона и переходят в эпителий кожи и слизистых оболочек. Рецидивирующий герпес развивается на фоне ограниченной гиперемии, с появлением пузырьков, содержащих прозрачный экссудат. Пузырьки обычно располагаются группами, в местах первичного поражения, там же обычно возникают жжение, покалывание и болезненность. Общее состояние человека при этом обычно не изменяется, но иногда может повышаться температура. Содержимое пузырьков может ссыхаться в корку, которая затем отпадает, или пузырьки вскрываются, образуя эрозию. В среднем рецидив герпеса клинически длится около 1–1,5 недели.
После первичного заражения ВПГ навсегда встраивается в геном клетки-хозяина и никогда не элиминируется иммунной системой.
ВПГ имеет циклическую активность (в течение 2–21 дня формируются пузырьки с вирусными частицами), периоды ремиссии, во время которых язвочки пропадают. Цикл репродукции вируса составляет 10 часов. Постепенно у человека формируется противовирусный иммунитет, и частота и тяжесть рецидивов уменьшается.
Формы и симптомы вируса герпеса 1 и 2 типа

Диагностика вируса герпеса: симптомы и лабораторные исследования
Диагностика ВПГ складывается из данных клинического осмотра и результатов лабораторных исследований, особенно значимых при латентной форме.
Оральный (лабиальный) герпес легко диагностируется лишь при наличии внешних проявлений — везикул, ран или язв. На ранних стадиях, когда симптомы заболевания отсутствуют, диагностировать герпес можно только лабораторными методами, который подтверждается при выделении вируса в культуре клеток и четырехкратном повышении титра антител при активной форме заболевания.
Для подтверждения диагноза и выбора терапии используется цитологический метод (в соскобах со дна везикул, окрашенных по Райту, Романовскому — Гимзе, видны характерные для герпеса гигантские клетки с внутриядерными включениями). Однако этот метод малочувствителен и не позволяет, например, отличить ВПГ от опоясывающего лишая.
Серологический метод с IgM и иммуноточечным гликопротеином G-специфичному HSV-тесту даёт более чем 98‑процентную специфичность и позволяет, таким образом, различить HSV-1 и HSV-2 типы герпеса.
Фармакотерапия: как вылечить герпес
В настоящее время существуют два основных направления в лечении вируса простого герпеса в организме человека:
- противовирусная терапия
- комплексная — иммунотерапия (специфическая + неспецифическая) + противовирусная
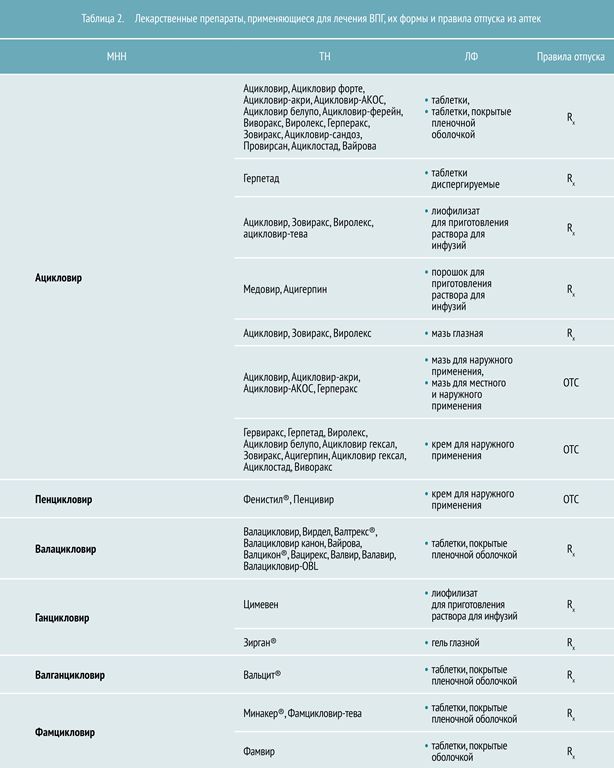
Противовирусная фармакотерапия
Ацикловир — противовирусный (противогерпетический) препарат, синтетический аналог нуклеозида тимидина, обладающий высокоизбирательным действием на вирусы герпеса. Внутри инфицированных клеток под действием вирусной тимидинкиназы проходит ряд последовательных реакций трансформации ацикловира в моно-, ди- и трифосфат ацикловира. Ацикловир трифосфат встраивается в цепочку вирусной ДНК и блокирует ее синтез посредством конкурентного ингибирования вирусной ДНК-полимеразы.
Специфичность и весьма высокая селективность действия также обусловлены его преимущественным накоплением в клетках, пораженных вирусом. Эффективен для большинства видов ВПГ, но лучший эффект достигается в лечении инфекций, вызванных herpes simplex типов 1 и 2, varicella zoster, слабее влияет на вирус Эпштейна — Барр и цитомегаловирусы.
После приема внутрь биологическая доступность ацикловира составляет 15–30 %, при этом создаются дозозависимые концентрации, достаточные для эффективного лечения вирусных заболеваний. Хорошо проникает во многие органы, ткани и жидкости организма, проникает через гематоэнцефалический и плацентарный барьеры, накапливается в грудном молоке. Связывание ацикловира с белками плазмы составляет 9–33 % и не зависит от его концентрации в плазме. Пища не оказывает значительного влияния на всасывание. Побочные реакции: тошнота, рвота, диарея, преходящее незначительное повышение активности ферментов печени, небольшое повышение концентрации мочевины и креатинина, гипербилирубинемия, головная боль, головокружение, анафилактические реакции, кожная сыпь, синдром Лайелла, синдром Стивенса — Джонсона, зуд, крапивница, сыпь, в том числе сенсибилизация. Таблетки и инъекционные формы ацикловира противопоказаны детям до 3‑х лет
Валацикловир — хлористоводородная соль L-валилового эфира ацикловира. Это пролекарство в организме абсорбируется из ЖКТ и при «первом прохождении» через кишечник и/или печень вследствие ферментативного гидролиза быстро и почти полностью (99 %) превращается в L-валин и ацикловир, который после фосфорилирования приобретает специфическую активность.
Побочные реакции: тошнота, рвота, гастралгия, снижение аппетита, повышение активности ACT, головокружение, головная боль, утомляемость, почечная недостаточность, микроангиопатия, гемолитическая анемия. Не зависит от приема пищи.
Пенцикловир — противовирусный препарат, активен в отношении вирусов herpes simplex 1 и 2 типа и varicella zoster. Пенцикловир попадает в инфицированные вирусом клетки, где под действием вирусной тимидинкиназы быстро превращается в монофосфат, который в свою очередь при участии клеточных ферментов переходит в трифосфат. Пенцикловира трифосфат находится в инфицированных вирусами клетках более 12 часов, подавляя в них синтез вирусной ДНК (дезоксирибонуклеиновой кислоты) и репликацию вирусов. Биодоступность пенцикловира — 77 %.
Побочные реакции: возможны жжение, пощипывание или онемение сразу же после нанесения препарата.
Фамцикловир — после приема внутрь фамцикловир быстро и почти полностью всасывается и превращается в активный пенцикловир.
Побочные реакции: головная боль, головокружение, повышение концентрации билирубина и активности «печеночных» трансаминаз, тошнота, рвота, диарея, боль в животе, кожная сыпь, зуд, повышенная потливость.
Ганцикловир — синтетический аналог 2′-дезоксигуанозина, который подавляет размножение вирусов герпеса. Активен в отношении цитомегаловируса человека (ЦМВ), вирусов простого герпеса 1‑го и 2‑го типа, вирусов герпеса человека 6, 7 и 8 типа, Эпштейна — Барр, ветряной оспы и гепатита В. В инфицированных клетках под действием вирусной протеинкиназы UL97 ганцикловир вначале фосфорилируется с образованием ганцикловира монофосфата, под действием клеточных киназ переходит в трифосфат, а затем подвергается медленному внутриклеточному метаболизму. Так как фосфорилирование ганцикловира в большой степени зависит от действия вирусной киназы, оно происходит преимущественно в инфицированных клетках. Рекомендуется принимать во время еды.
Валганцикловир — L-валиловый эфир (пролекарство) ганцикловира, после приема внутрь быстро превращающийся в ганцикловир под действием кишечных и печеночных эстераз. Рекомендуется принимать во время еды.
Все перечисленные выше препараты — средства «скорой помощи» при любых формах герпеса.
Иммунотерапия простого герпеса
Нарушение иммунного ответа — одно из важнейших звеньев в патогенезе простого герпеса, так как часто заболевание протекает на фоне подавления иммунных реакций. Происходит снижение общего количества Т- и В-клеток, изменение их функциональной активности, наблюдаются нарушения в макрофагальном звене иммунитета, в системе интерферона.
Неспецифическая иммунотерапия включает в себя использование:
- иммуноглобулина;
- интерферонов и индукторов интерферона;
- препаратов, стимулирующих Т- и В-звенья клеточного иммунитета и фагоцитоз.
Механизм действия иммуноглобулинов при герпесе длительное время объясняли заместительным эффектом на фоне присущей этому заболеванию несостоятельности гуморального иммунитета. В последние годы было установлено, что препараты иммуноглобулинов обладают также иммуномодулирующим и антитоксическим действием, активируют опсоно-фагоцитарные реакции.
Для лечения рецидивирующего герпеса применяют иммуноглобулин человеческий нормальный. Препарат содержит достаточное для достижения терапевтического эффекта количество специфических противогерпетических антител.
Интерферон (ИФ) — фактор естественного иммунитета, продуцируется клетками в ответ на воздействие вирусов, бактерий, чужеродных антигенов и активирует реакцию элиминации возбудителей инфекции. Помимо противовирусной активности интерферон обладает антипролиферативным и иммунорегулирующим действием. ИФ повышает неспецифическую резистентность клеток (стимулирует фагоцитоз, увеличивает активность естественных киллеров). Широкий спектр противовирусной активности, отсутствие резистентных к интерферону штаммов вирусов предопределили перспективу его использования как средства этиопатогенетической терапии простого герпеса.
Для лечения различных форм рецидивирующего герпеса используются рекомбинантный альфа-2а интерферон и созданный комбинированный препарат, который состоит из иммуноглобулинов и рекомбинантного альфа-2а интерферона в виде суппозиториев для ректального и вагинального введения.
С помощью препаратов интерферона (природных или генно-инженерных) осуществляется заместительная терапия, в результате чего может блокироваться продукция собственного эндогенного ИФ пациента. Это необходимо принимать во внимание при назначении длительных (более двух недель) курсов ИФ-терапии, особенно генно-инженерных форм. В случаях длительного назначения больным ИФ отменять их следует постепенно, снижая частоту приема до трех, далее двух раз в неделю с последующей полной отменой препарата.
Тилорон, тетрагидроксиглюкопиранозилксантен — индукторы ИФ, стимулируют выработку эндогенного ИФ в организме больного. Это объясняет терапевтический эффект перечисленных препаратов при многих вирусных заболеваниях (рецидивирующем герпесе, гриппе, аденовирусной инфекции), что позволяет рекомендовать их в комплексном лечении всех герпетических заболеваний, особенно у больных, страдающих частыми простудными заболеваниями и ОРВИ.
Специфическая иммунотерапия состоит в применении герпетической вакцины (поливалентной, тканевой, инактивированной). Лечебный эффект вакцины связан со стимуляцией специфических реакций противовирусного иммунитета, восстановлением функциональной активности иммунокомпетентных клеток и специфической десенсибилизацией организма.
Комплексное лечение вируса простого герпеса
Учитывая патогенез, целесообразно использовать препараты с различным механизмом действия. Это препятствует появлению резистентных штаммов ВПГ, а применение интерферонов и их индукторов в сочетании с герпетической вакциной и иммуномодуляторами позволяет комплексно решать вопросы терапии. В таблице 2 представлены препараты, зарегистрированные на территории РФ для лечения ВПГ.Препараты при лечении вируса герпеса
Источник


