Герпес у больных с иммуносупрессиями
Комментарии
Опубликовано в журнале
Терра Медика Нова »» № 2 ’99
ИНФЕКЦИОННЫЕ БОЛЕЗНИ
В.А. Исаков, М.М. Сафронова, Ю.В. Аспель
НИИ гриппа РАМН, МАПО, Санкт-Петербург, Россия
В практической работе врачи часто встречаются с развитием у больных вторичных иммунодефицитных состояний (ИДС) различного генеза. Причиной иммуносупрессии могут быть перенесенные вирусные или бактериальные инфекции, солнечная инсоляция, переохлаждение, радиационное облучение, плохое питание, тяжелое соматическое заболевание, обширная хирургическая операция, онкологическая и гематологическая патологии и пр. ИДС характеризуется нарушениями в различных звеньях иммунитета, что способствует активации латентных вирусных и бактериальных инфекций (таких как представители семейства герпесвирусов (ГВ), аденовирусы и некоторые другие респираторные вирусы, ВИЧ, хламидии, микоплазмы). Необходимо подчеркнуть, что клинические проявления инфекции (в том числе и ГВ-инфекций), протекавшие ранее латентно, могут быть тяжелыми на фоне ИДС, с тенденцией к генерализации и возникновению осложнений, которые подчас определяют развитие и исход основного заболевания, создавая угрозу для здоровья и жизни пациента. Так, отмечено, что если у пациента с нормальной иммунной реакцией крайне редко встречаются осложнения после перенесенного простого герпеса, то после трансплантации костного мозга, которая сопровождается субтотальным облучением тела и иммуносупрессивной терапией, до 2% больных имеют поражения ЦНС, такие как вирусный асептический менингит, менингоэнцефалит, поперечный миелит или некротическая миелопатия [7].
Классификация клинических форм герпесвирусной инфекции (ГИ) у лиц с иммунодефицитными состояниями (Исаков ВА, Сафронова М.М., 1997)
I. Простой герпес
Атипичные формы
Зостериформный простой герпес (ПГ)
Герпетиформная (герпетическая) экзема Капоши
Язвенно-некротическая форма ПГ
Генерализованные формы
Висцеральная форма (менингит, энцефалит, гепатит и др.)
Диссеминированная форма (поражение многих органов и систем)
II. Ветряная оспа — опоясывающий герпес
Гангренозная форма
Геморрагическая форма (тяжелые осложнения: пневмония, энцефалит, миокардит, гепатит)
Язвенно-некротическая форма
Генерализованная форма
III. Инфекция вирусами Эпштейна-Барра
Септическая форма инфекционного мононуклеоза
Лимфома Беркитта (новообразование челюсти, поражение слюнных и щитовидной желез, других органов)
Лейкоплакии слизистых оболочек языка, полости рта, реже — половых органов
Назофарингеальная карцинома
IV. Цитомегаловирусная инфекция
Генерализованная форма инфекции
Гепатит (подострый и хронический)
Пневмония (в сочетании с бактериальными осложнениями)
Энцефалит
V. Инфекция вирусами герпеса человека 6-го и 7-го типов
Генерализованные формы инфекции
Энцефалиты
Пневмонии
Лимфаденопатии
Инфекция при острых лейкозах, развившаяся после трансплантации органов; при СПИДе, коллагенозах и др.
VI. Инфекция вирусом герпеса человека 8-го типа
Инфекция при саркоме Калоши, ассоциированной с ВИЧ-инфекцией и СПИДом
Генитальный герпес (ГГ) встречается у 6%-10% взрослых. ГВ-инфекций наблюдаются у 2% людей, среди онкологических больных — у 50%, при ВИЧ-инфекции и СПИДе — у 95% [1-3]. При этом показано, что прогностически наиболее значимо комплексное определение ДНК ВПГ-1, ЦМВ и ВГЧ-6 (метод дот-гибридизации) у больных с ВИЧ-инфекцией [2]. Доказано, что ГВ являются кофакторами активации и прогрессирования ВИЧ-инфекции и СПИДа.
Следует отметить возможную роль вируса простого герпеса-2 (ВПГ-2) (в ассоциации с паповавирусами, цитомегаловирусом, хламидиями и микоплазмами) в развитии неопластических процессов у человека, в частности рака шейки матки и рака предстательной железы. Считают, что в этом случае ВПГ-2 может выступать в качестве кофактора канцерогенеза, инициируя развитие дисплазии и поддерживая ее в состоянии стабилизации [4]. Важная роль как этиологического фактора развития дисплазии и рака шейки матки сегодня отводится вирусу папилломы человека (особенно неблагоприятно сочетание ВПГ-2 с паповавирусами), поэтому женщины с подтвержденной папилломавирусной инфекцией должны ежегодно проходить осмотр у гинеколога с выполнением цитологического исследования цервикальных мазков.
Клинические проявления основного заболевания у пациентов со злокачественными новообразованиями и с гематологическими заболеваниями сопровождаются транзиторной иммуносупрессией, которая нередко еще более усугубляется вследствие осложнений, возникающих при стандартных методах лечения данных больных (лучевая терапия, химио- и гормонотерапия, хирургическое лечение).
При ИДС меняются клинические проявления вирусных инфекций, а следовательно, и тактика врача по ведению данных больных. В частности, важны своевременная и рациональная противовирусная терапия, оптимальные схемы лечения герпеса. Если ослаблен иммунологический контроль, то не только становится невозможной полная элиминация внутриклеточно расположенного вируса, но и создаются благоприятные условия для распространения вирусов от клетки к клетке по межклеточным мостикам или экстрацеллюлярным путем, то есть для распространения и генерализации герпесвирусной инфекции (ГИ), которая протекает тяжело.
ГГ сопровождается поражением у женщин влагалища, цервикального канала, шейки и полости матки, яичников, уретры и мочевого пузыря, у мужчин — уретры, мочевого пузыря, простаты, семенников. При орогенитальных контактах инфицируются миндалины, слизистые полости рта, при аногенитальных — область ануса, прямая кишка. На фоне ИДС характерно развитие тяжелых язвенно-некротических повреждений половых органов, в том числе при СПИДе. Часто встречается регионарный лимфаденит, редко — лимфостаз и, как результат, слоновость половых органов.
Внезапное увеличение частоты рецидивов ГИ, распространение и миграция очагов поражения иногда возникают раньше, чем клинические симптомы развивающейся злокачественной опухоли любой локализации. Таких пациентов необходимо тщательно обследовать, особенно если нет других причин для развития иммунодефицита. Женщины, страдающие рецидивирующим ГГ, должны пройти осмотр у гинеколога с выполнением кольпоскопии для ранней диагностики рака шейки матки.
Клинический исход первичной ГИ в значительной мере определяется иммунным статусом организма. В то же время характер патогенетических изменений в организме больных ГГ обусловлен преимущественно возможностью интеграции генома вируса в геном клетки-хозяина, в частности в паравертебральных сенсорных ганглиях, а также тропностью ВПГ и других ГВ к форменным элементам крови и иммуноцитам. Это во многом способствует пожизненной персистенции структур ВПГ в организме больного и обусловливает изменение клеточного и гуморального иммунитета. Более того, на сегодняшний день ГИ рассматривается как инфекционная (приобретенная) болезнь иммунной системы [5], при которой длительная персистенция вируса в ряде случаев сопровождается продуктивной инфекцией ВПГ во всех видах клеток иммунной системы, что проявляется их функциональной недостаточностью и способствует формированию иммунодефицита. Нами, а также другими исследователями показано, что основная роль в формировании противогерпетического иммунитета принадлежит клеточным факторам: их состояние во многом определяет исход первичного инфицирования, частоту и напряженность рецидивов заболевания. Длительность иммунодефицита при вирусных инфекциях зависит главным образом от свойств самого вируса, а также от реактивности организма больного.
В последние годы появились сообщения, указывающие на возможность формирования резистентных штаммов ВПГ при использовании ацикловира (АЦ) [6]. Причем устойчивые к АЦ штаммы вируса герпеса чаще выделяются у больных с герпетическими пневмониями, энцефалитами, кожно-слизистой формой ГИ на фоне выраженного иммунодефицита [1-2, 7]. По нашему мнению, тестирование клинических изолятов ВПГ на чувствительность к химио-препаратам является необходимым звеном индивидуальной тактики ведения больных ГИ, особенно в тех случаях, когда имеет место тяжелое течение заболевания, а терапия неэффективна.
Противовирусная терапия герпесвирусных инфекций у лиц с иммунодефицитными состояниями [8]
I. Простой герпес
Ацикловир. Лечебные дозы: 400 мг 5 раз в 1 сут внутрь, курс 10-14 дн; 500 мг/м2 З раза в 1 сут внутривенно, курс 10 дн. Профилактическая доза: 400 мг 4 раза в 1 сут внутрь, курс несколько недель или месяцев.
Валацикловир. Лечебная доза: 500 мг 2 раза в 1 сут внуть, курс 10 дн.
Фамцикловир. Лечебные дозы: 500 мг или 750 мг 3 роза в 1 сут внутрь, курс 7-14 дн; 5 мг/кг каждые 8 ч внутривенно, курс 7-10 дн.
II. Ацикловир-резистентная герпетическая инфекция
Фоскарнет. Лечебная доза: 60 мг/кг массы тела 3 раза в 1 сут внутривенно, курс 10-14 дн.
Ганцикловир. Лечебная доза: 5 мг/кг массы тела 3 раза в 1 сут внутривенно, курс 10-14 дн.
Видарабин. Лечебная доза: 10 мг/кг массы тела 3 раза в 1 сут внутривенно, курс 10-14 дн.
III. Ветряная оспа — опоясывающий герпес
Ацикловир. Лечебные дозы: 800 мг 5 раз в 1 сут внутрь, либо 250-500 мг/м2 2-3 раза в 1 сут внутривенно, курс 7-10 дн; после трансплантации костного мозга — 500 мг/м2 3 раза в 1 сут внутривенно, курс 7-10 дн; далее 800 мг/м2 5 раз в 1 сут последующие 6 мес; при неврологических осложнениях на фоне иммунодефицита — 250-500 мг/м2 3 раза в 1 сут внутривенно, курс 7-10дн (при любых формах герпетической инфекции); при постгерпетической невралгии — 800 мг 2 раза в 1 сут внутрь, курс 3-4 мес.
Валацикловир. Лечебная доза: 1000 мг 3 раза в 1 сут внутрь, курс 7 дн.
Фамцикловир. Лечебные дозы для взрослых: 250-500 мг 3 раза в 1 сут внутрь, курс 7 дн.
IV. Цитомегаловирусная инфекция
Ганцикловир. Лечебная доза: 5 мг/кг массы тела/сут внутривенно, курс 2-3 нед. Профилактическая доза: 5 мг/кг массы тела/нед, курс 4-5 мес.
Фоскарнет. Лечебная доза: 60 мг/кг массы тела 3 раза в 1 сут внутривенно (введение в течение 2 ч), курс 10-14 дн.
Лечение герпеса у ВИЧ-инфицированных и больных СПИДом с использованием в комплексной терапии препаратов различного механизма действия имеет свои особенности. Исследование проводилось на базе городского центра по борьбе со СПИДом в С.-Петербурге.
У ВИЧ-инфицированных больных кожно-слизистая форма рецидивирующего простого герпеса отмечалась у 13 из 24 взрослых и у 16 из 47 детей. Для лечения пациентов со смешанной инфекцией (герпес в сочетании с ВИЧ-инфекцией) использовали ретровир (азидотимидин) в дозах, в 2 раза ниже рекомендуемых. Ретровир в сочетании с ацикловиром назначали постоянно или прерывистыми курсами.
Взрослые пациенты принимали ретровир в сочетании с ацикловиром (в дозе 1-2 г/сут) прерывистыми курсами в течение 2 мес. Дети в возрасте 3,5-5 лет получали ретровир в виде сиропа или в капсулах по 100 мг 3 раза в 1 сут в сочетании с ацикловиром по 200 мг 5 раз в 1 сут в течение 14 дн и далее по 200 мг 2 раза в 1 сут в течение 2 мес. На фоне лечения смешанной инфекции у взрослых и детей отмечался существенный клинический эффект, улучшались иммунологические показатели. У детей, принимавших ретровир постоянно (9-12 мес) в сочетании с ацикловиром, после лечения наблюдались более высокие показатели отношения CD4/СD8, количества CD4-лимфоцитов, иммуноглобулинов А и М, содержания гемоглобина, чем у детей, получавших противовирусные препараты прерывистыми курсами. Пo окончании приема ретровира у больных возникали рецидивы герпетической инфекции. В связи с этим мы считаем целесообразным назначение поддерживающих доз противовирусных препаратов в период клинической ремиссии герпеса у ВИЧ-инфицированных, использование противорецидивных курсов лечения, что предупреждает обострение простого герпеса и прогрессирование ВИЧ инфекции.
Таким образом, при лечении ГВ-инфекций у больных с ИДС необходимо сразу назначать более высокие дозы и более продолжительные курсы (в том числе и повторные) специфической противовирусной терапии, нередко сочетая системное и местное их применение. Наилучшие результаты дает комплексное лечение таких больных с одномоментным использованием препаратов разнонаправленного механизма действия (противогерпетические средства, антиоксиданты, препараты с антипротеазной активностью, интерфероны и их индукторы) и санацией очагов инфекции.
Литература
1. Лепков СВ. Зовиракс у онкологических больных. Алкеран, лейкеран, милеран, 6-меркаптопурин, 6-тиогуанин, веллферон, зовиракс в онкологической практике. М: ИПО «Полигран», 1994:92-6.
2. Исаков ВА, Борисова ВВ, Исаков ДВ. Герпес: патогенез и лабораторная диагностика: Руководство для врачей. СПб: Лань, 1999.192 cc.
3. Рахманова АГ, Пригожина ВК, Неверов ВА. Инфекционные болезни. Руководство для врачей общей практики. М, СПб, 1995. 302 сс.
4. Бохман ЯВ, Лютра УК. Рак шейки матки. Кишинев: Штиинца, 1991. 239 сс.
5. Баранский ИФ, Шубладзе АК, Каспаров АА, Гребенюк ВП. Герпес (этиология диагностика лечение). М: Медицина, 1986. 206 сс.
6. Брязжикова ТС, Исаков ВД, Юрлова ТИ, Голованова АК. Варьирующая чувствительность клинических изолятов вируса простого герпеса разных лет выделения к ацикловиру. Вест РАМН 1995; (9): 12-5.
7. Исаков ВА. Современные методы лечения герпетической инфекции. Terra Medica Nova 1997; (3): 2-7.
8. Исаков ВА, Ермоленко ДК, Черных МД. Терапия герпетической инфекции. СПб: Гиппократ, 1993.40 сс.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
а) Герпесвирусная инфекция при хронической иммуносупрессии. К герпесвирусам относятся ВПГ-1, ВПГ-2, вирус varizella-zoster (VZV), вирус герпеса человека типа 6 (ВГЧ-6), ВГЧ-7, вирус Эпштейна-Барр (ВЭБ) и герпесвирус, ассоциированный с саркомой Капоши. Инфекции чаще всего встречаются у пациентов с приобретенными дефектами клеточного иммунитета. Герпесвирусы инфицируют организм человека пожизненно и остаются пассивными в ядрах латентно инфицированных клеток. Подавление иммунитета часто приводит к их реактивации (переключению из латентного в действующее состояние).
Рецидивирующие инфекции вирусов ВПГ-1, ВПГ-2 и VZV типичны для онкологических пациентов и для пациентов, перенесших трансплантацию, причем в большинстве случаев отмечается реактивация как минимум одного из трех этих вирусов. Клинически выраженные обострения герпетической инфекции наблюдаются у 68% больных, перенесших трансплантацию и не получающих соответствующей профилактической терапии.
Опоясывающий герпес (возвратное проявление инфекции, вызванной вирусом Варицелла-Зостер) наиболее часто возникает в течение года после трансплантации органа, поражая лиц с иммуносупрессией в 20-100 раз чаще (примерно 10% всех реципиентов трансплантата). Хотя проявления инфекции могут быть идентичны высыпаниям у иммунокомпетентных лиц, возможны высыпания с атипичной морфологией и локализацией. Например, у иммуносупрессивных пациентов рецидивирующие очаги вследствие инфекции ВПГ или VZV могут быть разрозненными и расположенными несоответственно дерматомам, диссеминированными, некротическими, язвенными или веррукозными. В полости рта хроническая рецидивирующая инфекции ВПГ может образовывать белые бляшки и клинически имитировать кандидоз. Встречаются очаги в необычной локализации, например, на языке.
Сильная боль часто ассоциируется с высыпаниями как на коже, так и в полости рта, характерна также постгерпетическая боль. Длительное клиническое течение рецидивирующих инфекций ВПГ или VZV также чаще наблюдается на фоне иммуносупрессии. В целом любой болезненный эрозивный очаг у иммунокомпромиссного пациента, независимо от локализации очага и возраста пациента, следует оценить на наличие и ВПГ и VZV с помощью препарата Тцанка, иммунофлоуресцентного исследования на антиген вируса, полимеразной цепной реакции и/или вирусной культуры. Важно отметить, что возможна системная инфекция с поражением легких, центральной нервной системы, печени, сердца и желудочно-кишечного тракта. Всегда необходимо проводить лечение системным ацикловиром или родственным антигерпесвирусным препаратом. Отдельным пациентам для предупреждения рецидивов рекомендуется профилактическая терапия. При инфекционном процессе вызванном, устойчивыми к ацикловиру вирусами, препаратом выбора является фроскарнет.
Реактивация цитомегаловируса и повторное обострение заболевания вносит существенный вклад в болезненность и смертность пациентов с выраженной иммуносупрессией и наблюдаются у 20-60% реципиентов, перенесших трансплантацию. Процент пораженных лиц зависит от типа трансплантата и других факторов риска.
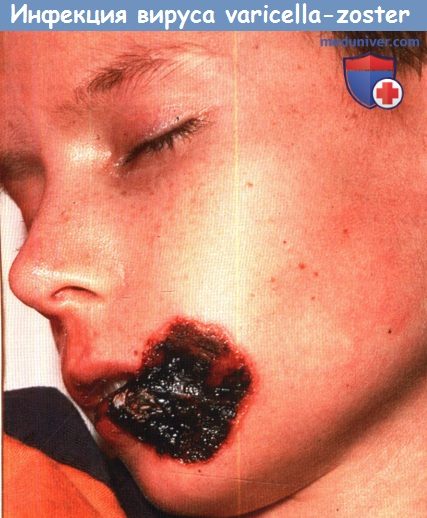
Тяжелая хроническая инфекция, вызванная вирусом простого герпеса у пациента,
длительно получавшего высокие дозы глюкокортикоидов по поводу аутоиммунного заболевания.
Заболевание чаще всего обусловлено реактивацией существующего в организме хозяина цитомегаловируса, однако возможна и передача от донора вместе с трансплантатом. Данный вирус также способен оказывать непрямое воздействие на организм реципиента, что ведет к повышению риска отторжения трансплантата и развитию других оппортунистических инфекций. Цитомегаловирусный ретинит, гастроэнтерит, гепатит и пневмонит — наиболее распространенные клинические проявления заболевания. Разнообразные неспецифические кожные очаги в 10-20% включают язвы, папулы, везикулы, петехии и кореподобные высыпания. Вызванные ЦМВ язвы в полости рта, в частности, на боковых участках языка, встречаются особенно часто. Болезненные перианальные язвы вдавленной формы были описаны у этой группы больных. Также может иметь место коинфекция с вирусом простого герпеса.
Проба Тцанка на материале из основания язв, при микроскопическом исследовании тканевых срезов, выявляет многоядерные гигантские клетки и инфицированные ЦМВ дермальные эндотелиальные клетки, которые выглядят как крупные клетки с внутриядерными включениями, окруженные светлым ободком (ядра по типу «глаза совы»). Кроме того, культуру ЦМВ можно получить из инфицированной кожи. Терапией выбора при системной инфекции ЦМВ является внутривенное введение ганцикловира, хотя эффективны также внутривенный фоскарнет, цидофовир или иммуноглобулин ЦМВ. Профилактика у лиц, находящихся в группе риска, должна носить плановый характер.
Герпесвирусы ВГЧ-6 и ВГЧ-7, близкородственные ЦМВ, у иммуносупрессивных пациентов также могут вызвать распространенную инфекцию с поражением многих органов. Заболевание само по себе течет относительно мягко, однако непрямые эффекты вирусной реактивации облегчают развитие других вирусных инфекций и увеличивают вероятность отторжения трансплантата.
Инфицирование вирусами Эпштейна-Барр и герпес-вируса, ассоциированного с саркомой Капоши, отличаются от других тем, что на фоне иммуносупрессии они ассоциируются со злокачественными заболеваниями. В частности, хроническая реактивированная инфекция, вызванная вирусом Эпштейна-Барр, ассоциируется с нехождкинской лимфомой и другими лимфопролиферативными заболеваниями, а хроническая инфекция герпесвируса, ассоциированного с саркомой Капоши, связана с саркомой Капоши, первичной эффузионной лимфомой и плазмобластным вариантом болезни Кастелмана. Их неопластический потенциал обсуждается ниже. Волосатая лейкоплакия полости рта — особое проявление реактивации вируса Эпштейна-Барр в эпителиальных клетках слизистой полости рта, которая наблюдается у пациентов со СПИДом, а также у других иммуносупрессивных лиц. Очаги возникают как плотно прилегающие белые морщинистые бляшки на боковых участках языка.
Гистологически наблюдается гиперкератоз и вакуолизация надбазальных эпителиальных клеток. Волосатая лейкоплакия полости рта может реагировать на местный подофиллин или высокие дозы ацикловира, однако обычно протекает бессимптомно и не требует лечения.
Хотя у ВИЧ-инфицированных лиц волосатая лейкоплакия полости рта считается плохим прогностическим признаком, ее клиническое значение у пациентов с трансплантатами пока неизвестно.

Тяжелая рецидивирующая инфекция, вызванная вирусом varicella-zoster у пациента с острым лимфоцитарным лейкозом.
б) Инфицирование вирусом папилломы человека. Бородавки, вызванные вирусом папилломы человека (ВПЧ), являются распространенной проблемой после трансплантации, а также после длительной иммуносупрессивной медикаментозной терапии. Частота обострений увеличивается по мере удлинения срока иммуносупрессии. Так спустя 5 лет после трансплантации они наблюдаются у 95% больных. В таких условиях очаги многочисленные, стойкие и трудно поддаются эрадикации. Морфология очагов бывает типичной и нетипичной.
Нетипичные очаги появляются в виде шелушащихся пятен и бляшек, чаще наблюдаются на открытых воздействию солнечного света участках тела и ассоциируются с теми типами вируса ВПЧ, которые встречаются у пациентов с верруциформной дисплазией эпидермиса (в частности, ВПЧ типов 5 и 8). В некоторых исследованиях было показано, что системные ретиноиды (такие как изотретиноин или ацитретин) могут предупреждать или уменьшать образование бородавок и предотвращать развитие ряда предраковых и злокачественных кожных очагов у пациентов после трансплантации. В этой группе пациентов связь между вирусом простого герпеса и плоскоклеточного рака негенитальной локализации является более сложной и будет обсуждаться ниже.
в) Инфицирование полиомавирусом человека при хронической иммуносупрессии. Полиомавирусы, характеризующиеся наличием двойной цепи ДНК и небольшим размером, обнаруживаются у многих видов, включая человека. Первые два вида этих вирусов (BKV и JCV) были описаны в семидесятые годы прошлого века. ВК вирус (BKV) вызывает нейропатию у пациентов, перенесших трансплантацию почки, a JC вирус (JCV) — прогрессирующую мультифокальную лейкоэнцефалопатию у пациентов с иммуносупрессией. Ни один из этих двух видов не способен вызывать кожные высыпания.
В 2008 году был идентифицирован еще один вид полиомавируса. Он был выделен из раковой опухоли, представленной клетками Меркеля (карцинома Меркеля, см. главу 120 и ниже в этой главе). В дальнейшем этот вид вируса получил название полиомавируса клеток Меркеля (Merkel cell polyomavirus — MCPyV). Данный вид обнаруживается у 24-89% больных карциномой Меркеля и отличается наиболее высокой распространенностью в Европе и Северной Америке. Его способность встраиваться в геном карциномы позволяет предположить возможную онкогенную роль. Факторами риска развития карциномы Меркеля являются пожилой возраст и избыточная инсоляция, причем распространенность существенно увеличивается в группе лиц с иммуносупрессией, особенно перенесших трансплантацию органов.
— Рекомендуем далее ознакомиться со статьей «Рак кожи при хронической иммуносупрессии»
Оглавление темы «Болезни кожи при хронической иммуносупрессии.»:
- Бактериальные инфекции кожи при хронической иммуносупрессии
- Грибковые инфекции кожи при хронической иммуносупрессии
- Вирусные инфекции кожи при хронической иммуносупрессии
- Рак кожи при хронической иммуносупрессии
Источник


