Национальная программа лечения атопический дерматит у детей

К сожалению достаточно часто даже при выполнении всех рекомендаций у детей, родившихся от матерей, страдающих бронхиальной астмой, развивается атопический дерматит (диатез). В каждом конкретном случае причиной его может быть какой-либо фактор окружающей среды, пищевой агент, нарушение правил проведения профилактических вакцинаций, лечение антибактериальными препаратами (в особенности пенициллиновой группы). Поисками причины развития кожного процесса должен заниматься педиатр-аллерголог, однако существуют общие направления в лечении атопического дерматита (АД):
- диетотерапия (мероприятия по исключению пищевых аллергенов);
- контроль за окружающей ребенка средой;
- уход за кожей.
Лечебное питание является важнейшей составляющей частью профилактики и комплексного лечения детей с АД и имеет своими целями максимальное уменьшение аллергенного воздействия пищи на организм ребенка и создание условий для нормализации функционального состояния органов пищеварения.
Гипоаллергенная диета при АД строится с учетом следующих принципов:
- Исключение из питания причинно-значимых аллергенов (выявленных клинически и специальными методами диагностики — кожными и лабораторными тестами), а также исключение продуктов, содержащих экстрактивные вещества, консерванты и красители.
- Адекватная замена исключенных продуктов натуральными или специализированными лечебными продуктами в соответствии с возрастными потребностями и особенностями функционального состояния органов пищеварения ребенка.
Характеристика так называемой «неспецифической гипоаллергенной диеты» для детей старше 1 года, т. е. имеющих полный рацион питания, представлена ниже. При приготовлении пищи необходимо соблюдать щадящую ку¬линарную обработку. Блюда готовятся на пару, отвариваются, запекаются. Пища детям после года жизни дается преимущественно в неизмельченном виде. Применяется предварительная специальная обработка некоторых продуктов (очищенный и мелко нарезанный картофель вымачивается в холодной воде в течение 12-14 ч, остальные овощи и крупы вымачиваются в течение 1-2 ч, мясо под¬вергают двойному вывариванию). Блюда не должны быть горячими.
Следует подчеркнуть, что вопрос о необходимости длительного применения гипоаллергенной диеты сегодня существенно пересматривается. Эта диета может приводить к пищевой недостаточности и нарушению физического развития ребенка, а также к серьезным психологическим проблемам в семье и неправильному социально-психологическому развитию ребенка. Поэтому жестко ограничительная диета должна рассматриваться как «стартовая», т. е. диета для начального этапа. Далее, в зависимости от степени тяжести течения АД и в процессе выяснения спектра индивидуально непереносимых продуктов, диета должна постепенно расширяться путем индивидуальной оценки переносимости тех или иных пищевых продуктов.
- бульоны, острые, соленые, жареные блюда, копчености, пряности, колбасные и гастрономические изделия (вареная и копченая колбасы, сосиски, сардельки, ветчина), печень
- рыба, икра, морепродукты
- яйца
- острые и плавленые сыры, мороженое, майонез, кетчуп
- овощи: редька, редис, щавель, шпинат, томаты, болгарский перец, квашеная капуста, соленые и маринованные огурцы
- грибы, орехи
- фрукты и ягоды: цитрусовые, земляника, клубника, малина, абрикосы, персики, гранаты, виноград, облепиха, киви, ананас, дыня, арбуз
- тугоплавкие жиры и маргарин
- газированные фруктовые напитки, квас
- кофе, какао, шоколад
- мед, карамель, зефир, пастила, торты, кексы (с ароматизаторами и пр.)
- жевательная резинка
- манная крупа, макаронные изделия, хлеб из муки высших сортов
- цельное молоко и сметана (дают только в блюдах, если нет признаков непереносимости), творог, йогурты с фруктовыми добавками
- баранина, курица
- ранние овощи (разрешены при условии обязательного предварительного вымачивания)
- морковь, репа, свекла, лук, чеснок
- фрукты и ягоды: вишня, черная смородина, бананы, клюква, ежевика, отвар шиповника
- сливочное масло
- крупы (кроме манной)
- кисломолочные продукты (кефир, биокефир, йогурты без фруктовых добавок и пр.)
- неострые сорта сыра
- постное мясо (говядина, свинина, кролик, индейка, конина),
- специализированные мясные консервы для детского питания
- овощи: все виды капусты, кабачки, патиссоны, светлая тыква, зелень петрушки, укропа, молодой зеленый горошек, стручковая фасоль
- фрукты: зеленые и белые яблоки, груши, светлые сорта черешни и сливы, белая и красная смородина, крыжовник
- топленое сливочное масло, рафинированное дезодорированное растительное масло (кукурузное, подсолнечное, оливковое и др.)
- фруктоза
- хлеб пшеничный второго сорта или «Дарницкий», хлебцы зерновые, несладкие кукурузные и рисовые палочки и хлопья
Безусловно, на неопределенно длительный срок должны исключаться продукты, содержащие красители, ароматизаторы и пр. («Кока-Кола», «Спрайт» и другие аналогичные напитки, жевательная резинка и пр.).
Следовательно, первый этап требует достаточно жестких ограничений в диете (вплоть до полного соблюдения условий «неспецифической гипоаллергенной диеты»), второй этап — поиск индивидуальных путей постепенного расширения диеты до физиологической, т. е. соответствующей возрасту ребенка.
Необходимо иметь в виду тот факт, что не всегда кожные реакции у детей младшего возраста связаны с аллергическими механизмами. В ряде случаев имеет значение незрелость ферментативных систем желудочно-кишечного тракта, которая постепенно уменьшается с ростом ребенка, и позволяет вводить в рацион питания те продукты, которые раньше исключались.
Уход за кожей является важнейшим направлением у детей, больных атопическим дерматитом. Одной из ошибок является запрещение купания детей, особенно при обострении АД. Напротив, эти пациенты нуждаются в ежедневном двадцатиминутном купании, которое очищает и увлажняет кожу, улучшает проникновение лекарственных препаратов, предотвращает инфицирование, доставляет удовольствие ребенку. Вода для купания не должна быть горячей. Дехлорирование воды проводится путем отстаивания воды в ванне в течение 1-2 ч с последующим ее согреванием или добавлением кипятка.
- не следует пользоваться мочалками, растирать кожу;
- желательно применять высококачественные моющие средства с нейтральным рН (5,5);
- после купания кожу промокнуть (не вытирать досуха!) полотенцем;
- нанести на еще влажную кожу, на участки повышенной сухости смягчающие специальные средства для ухода за кожей ребенка с атопией.
- подбирать средства гигиены, исключая использование агрессивных средств очистки, которые удаляют с кожи не только загрязнения, но и защитную гидролипидную пленку;
- оберегать кожу от использования чрезмерно жесткой воды;
- выбирать для стирки одежды порошки с неагрессивными моющими компонентами;
- избегать соприкосновения кожи с чрезмерно жесткой тканью и шерстью;
- не использовать горячую воду для душа и ванны;
- на пляже после купания тщательно промокнуть кожу полотенцем, так как процесс испарения воды высушивает эпидермис;
- защищать кожу от избыточного воздействия солнечных лучей;
- использовать специальные средства, предназначенные для ухода за кожей при АД.
Источник
В статье представлены результаты исследования, посвященного оптимизации клинической эффективности комплексной терапии детей с обострением IgE-опосредованного атопического дерматита путем включения в нее иммуномодулятора микробного происхождения — глюкозаминилмурамилдипептида.
Введение
В общей структуре аллергических заболеваний у детей большое внимание уделяется проблеме атопического дерматита (АтД) — мультифакторного воспалительного заболевания кожи, характеризующегося зудом, хроническим рецидивирующим течением, возрастными особенностями локализации и морфологии очагов поражения [1–3]. Среди многочисленных патогенетических факторов АтД (наследственная предрасположенность, дисбаланс внутриклеточных регуляторных механизмов, нарушение мембранной рецепции и др.) ведущую роль играет дисфункция иммунной системы с характерной генетически детерминированной гиперреактивностью гуморального звена иммунитета, дисбалансом в соотношении Th1-/Th2-лимфоцитов, нарушением цитокиновой регуляции [4–6], ослаблением фагоцитарных процессов [7]. Лечение АтД остается предметом пристального внимания для дерматологов, педиатров и аллергологов. Данное заболевание развивается с раннего возраста и имеет склонность к хронизации, рецидивированию, к поливалентной сенсибилизации и зачастую сопровождается возникновением осложнений и формированием различной сопутствующей патологии [5, 8], в т. ч. инфекционной, при которой патогенная микрофлора выполняет роль триггера обострений аллергических заболеваний [4, 9]. С точки зрения иммунопатогенеза АтД очевидна целесообразность использования в его комплексном лечении иммунотерапии, которая, не являясь этиотропной, способствует уменьшению вторичных проявлений аллергического процесса [10]. Предпочтительными препаратами выбора могут быть иммунотропные средства, способные влиять на соотношение Th1-/Th2-клеток. В этой связи внимания заслуживает минимальный биологически активный фрагмент мурамилдипептидов (МДП) — глюкозаминилмурамилдипептид (ГМДП), который в сравнении с МДП более активен с иммунологической точки зрения и при этом менее пирогенен [11]. ГМДП является активным веществом отечественного иммуномодулятора Ликопид (АО «Пептек», Россия), который уже более 20 лет удачно совмещает в себе высокую биологическую активность и хороший профиль безопасности, а его важным преимуществом является известный механизм и молекулярная мишень действия [12, 13].
Целью исследования явилась оптимизация клинической эффективности комплексной терапии детей с обострением IgE-опосредованного АтД путем включения в нее иммуномодулятора микробного происхождения — ГМДП (Ликопида).
Материал и методы
В исследование включены 85 детей в возрасте от 6 до 9 лет с обострением IgE-опосредованного АтД средней степени тяжести, не имеющих на момент обследования признаков клинической манифестации сопутствующей бактериальной, вирусной и микотической инфекции. Дети были распределены на 3 основные клинические группы, равноценные по течению и распространенности кожного поражения и отличающиеся по способам лечения: 1-я группа — 30 пациентов, получавших, кроме комплексной терапии, ГМДП (Ликопид) одним курсом; 2-я группа — 25 пациентов, находившихся на традиционном лечении без иммунотерапии; 3-я группа — 30 пациентов, получавших, кроме традиционной терапии, ГМДП (Ликопид) двумя курсами с интервалом 2 мес.
Традиционная терапия включала: гипоаллергенный быт, элиминацию причинно-значимых и облигатных аллергенов, использование противовоспалительной (местной и системной), в т. ч. антигистаминной, терапии и при необходимости — коррекцию дисфункций желудочно-кишечного тракта.
Критериями клинической эффективности в клинических группах были приняты распространенность кожных поражений, их интенсивность и субъективные ощущения больных, зафиксированные в специальных картах, заполненных в соответствии с SCORAD (scoring of atopic dermatitis — шкала оценки атопического дерматита). Исследование проводилось согласно научно-практической программе «Атопический дерматит и инфекции кожи у детей: диагностика, лечение и профилактика» (2004), которая включает оценку эффективности новых методов лечения. При этом учитывались 6 признаков интенсивности поражений в виде эритемы, отека/папул, мокнутий/корок, экскориации, лихенификации, сухости (невоспаленной кожи) по шкале от 0 до 3 баллов: 0 — отсутствие, 1 — слабое выражение, 2 — умеренное выражение, 3 — резкое выражение. Распространенность патологического кожного процесса оценивалась в процентах по правилу «девяток» (голова и шея — по 9%, передняя и задняя поверхность туловища — по 18%, верхние конечности — по 9%, нижние конечности — по 18%, область промежности и половые органы — по 1%). Субъективные симптомы у пациентов (зуд, нарушение сна) оценивались в баллах от 0 до 10.
Индекс SCORAD рассчитывали по формуле:
ИС = А / 5 + 7В / 2 + С,
где: А — распространенность кожных поражений, В — интенсивность клинических проявлений, С — субъективные симптомы.
Исследование клинических показателей, включая расчет индекса SCORAD, проводили в динамике: до лечения, через 1, 2 и 6 мес. от начала лечения.
Совместно с традиционным лечением иммунотерапия проводилась по следующей схеме: Ликопид сублингвально за 30 мин до еды по 1 мг 2 р./день в течение 5 дней, затем по 1 мг 1 р./день в течение 15 дней (суммарная доза препарата 25 мг) одним курсом — в 1-й клинической группе и двумя курсами (суммарная доза препарата 50 мг) с интервалом 2 мес. — в 3-й клинической группе.
Результаты исследования
Анализ данных аллергологического анамнеза показал, что у 59,9% матерей обследуемых детей было осложненное течение беременности и родов, 33,1% матерей имели токсикозы беременности. У большинства детей с обострением АтД в анамнезе имели место сопутствующие заболевания в виде поллиноза рино-конъюнктивальной формы (у 23%), бронхиальной астмы (у 19%), аллергического ринита (у 10,8%), сухого ночного кашля (у 19%), острых респираторных инфекций от 2 до 8 раз в месяц (у 47%), ангины (у 10,8%), рецидивирующей стрептодермии (у 4,8%), рецидивирующего фурункулеза и ячменя (у 4,8%). Однако на момент обследования у пациентов отсутствовали клинические признаки указанных сопутствующих заболеваний и инфекций. Почти у 60% детей обострение АтД совпадало с кишечной дисфункцией (неустойчивый стул, склонность к запорам), дискинезией желчевыводящих путей (по данным УЗИ), диспанкреатизмом.
Кожные проявления АтД у детей носили полиморфный характер: кожа была сухая с сероватым оттенком, со скрытым или отрубевидным шелушением. Высыпания имели эритематозно-инфильтративный характер. У большей части детей (66%) воспалительные фолликулярные и лихеноидные папулы сливались и образовывали очаги лихенификации, имелись экскориации. У 23% обследуемых детей наблюдалось утолщение нижних век с гиперпигментацией наружного угла глаз.
На основании изучения и обработки специальных карт, заполненных на каждого пациента в соответствии с SCORAD, распространенность (А) патологического кожного процесса до лечения составила 25,33±2,38%, интенсивность (В) клинических проявлений — 8,40±0,52 балла, оценка субъективных симптомов (С), отражающих качество жизни, — 7,40±0,91 балла. Индекс SCORAD составил 41,86±2,56 балла. Таким образом, у детей диагностирован IgE-опосредованный АтД эритематозно-сквамозной и лихеноидной формы в стадии обострения в фазе выраженных клинических проявлений, с упорно-рецидивирующим течением (до 3–4 раз в год), длительными периодами обострения и локализацией участков лихенизации на сгибательных поверхностях конечностей и шее.
Распространенность кожных поражений у детей с обострением IgE-опосредованного АтД после традиционной терапии снизилась в 1,8 раза через 1 мес. и в 3 раза через 2 мес., тогда как включение в комплексную терапию ГМДП (Ликопида) показало сокращение площади поражения кожных покровов в 3,5 раза через 1 мес. и в 8,3 раза через 2 мес. (рис. 1).
Курс иммунотерапии ГМДП (курсовая доза 25 мг) привел к более выраженному, чем при традиционной терапии, уменьшению кожного зуда и нарушений сна: через 1 мес. более чем в 30 раз, через 2 мес. до полного отсутствия субъективных симптомов. Расчет индекса SCORAD показал позитивный клинический эффект сочетанной иммунотропной терапии, заключающийся в более выраженном его уменьшении относительно исходных значений и через 1 мес. (в 1,6 раза) и 2 мес. (в 6 раз) после традиционной терапии (рис. 2).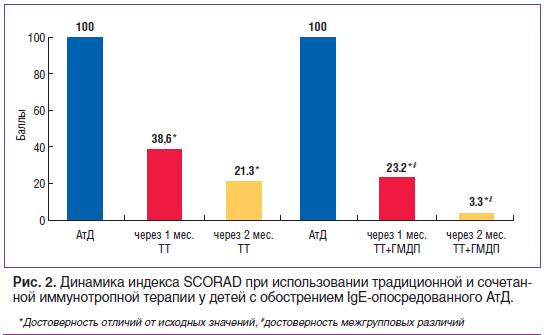
Дальнейшие катамнестические исследования в 1-й и 2-й группах, проведенные через 6 мес. от начала терапии, обнаружили случаи обострения сопутствующих заболеваний (ангины, аденоидиты, респираторно-вирусные инфекции, ночной кашель), более часто отмечаемые в группе детей, получавших традиционную терапию без ГМДП. Рецидивы обострения АтД были отмечены у детей обеих групп, однако при использовании традиционной терапии они наблюдались чаще — у 58% детей, тогда как у детей, получавших наряду с традиционным лечением иммуномодулятор Ликопид, они не превышали 35%. Эти результаты послужили основанием для формирования 3-й клинической группы детей с обострением IgE-зависимого АтД средней степени тяжести, сопоставимых по клинико-лабораторным данным с детьми 1-й и 2-й клинических групп. В 3-й группе использовалось 2 курса иммунотерапии ГМДП (Ликопидом) с интервалом 2 мес. (суммарная доза препарата — 50 мг) и оценкой ее клинической эффективности спустя 6 мес. после окончания терапии. Как показали результаты исследования, сочетанная с традиционным лечением иммунотерапия двумя курсами ГМДП (Ликопида) обладает более выраженным клиническим эффектом, о чем свидетельствует достоверное снижение числа обострений АтД в 1-й и 2-й группах в 3,4 раза и в 2 раза соответственно. Кроме того, при использовании модифицированного курса иммунотерапии наблюдалось более выраженное (в 3,2 раза), чем при традиционной терапии (в 1,5 раза), снижение числа случаев обострений сопутствующих заболеваний.
Обсуждение
При сравнении результатов 2 курсов иммунотерапии ГМДП (Ликопидом) в составе традиционного комплексного лечения IgE-опосредованного АтД у детей с результатами однократного курса иммунотерапии отмечена бóльшая эффективность в первом случае. Ранее нами были получены in vitro клинико-экспериментальные данные о способности ГМДП (Ликопида) достоверно снижать уровень общего сывороточного IgE [14] за счет усиления синтеза интерферона-γ и снижения продукции интерлейкина-4 [15], что открывает новые стороны действия ГМДП в качестве регуляторов дифференцировки Th1- и Th2-лимфоцитов в условиях повышенной активности последних.
Заключение
Эффективность ГМДП (Ликопида) в составе комплексной традиционной терапии IgE-опосредованного АтД эритематозно-сквамозной и лихеноидной формы в стадии обострения в фазе выраженных клинических проявлений, с упорно-рецидивирующим течением позволяет считать его препаратом выбора для иммунотерапии. Применение препарата в дозе 25 мг существенно сокращает площадь поражения кожных покровов и интенсивность клинических проявлений заболевания с полным исчезновением субъективных симптомов через 2 мес. от начала терапии. Кроме того, 2 курса ГМДП (Ликопида) в суммарной дозе 50 мг уменьшают частоту рецидивов АтД и сопутствующих заболеваний эффективнее, чем традиционная терапия.
Авторы Е.А. Коков, Н.В. Колесникова, Л.Н. Кокова заявляют об отсутствии конфликта интересов; Т.М. Андронова является сотрудником АО «Пептек».
Источник
1. Атопический дерматит и инфекции кожи у детей: диагностика, лечение, профилактика. Научно-практическая программа Союза педиатров России. М. 2004. 52 с.
2. Williams H.C. Diagnostic criteria for atopic dermatitis: where do we go from here? Arch. Dermatol. 1999; 135 (5): 583–586.
3. Rudikoff D., Lebwohl M. Atopic dermatitis. Lancet. 1998; 6 (351): 1715–1721.
4. Boguniewicz M., Fiedler V.C., Raimer S. et al. Randomized, vehicle-controlled trial of tacrolimus ointment for treatment of atopic dermatitis in children. Pediatric Tacrolimus Study Group. J. Allergy Clin. Immunol. 1998; 102: 637–644.
5. Sugiura H., Umemoto N., Deguchi H. et al. Prevalence of childhood and adolescent atopic dermatitis in a Japanese population: comparison with the disease frequency examined 20 years ago. Acta Derm. Venereol. 1998; 78 (4): 293–254.
6. Современная стратегия терапии атопического дерматита: программа действий педиатра Согласительный документ ассоциации детских аллергологов-иммунологов России. М. 2004. 96 с.
7. Kay J., Gawkrodger D.J., Mortimer M.J., et al. The prevalence of childhood atopic eczema in a general population. J. Am. Acad. Dermatol. 1994; 30 (1): 35–39.
8. Reid P., Lewis-Jones M.S. Sleep difficulties and their management in preschoolers with atopic eczema. Clin. Exp. Dermatol. 1995; 20 (1): 38–41.
9. Lawson V., Lewis-Jones M.S., Finlay A.Y. The family impact of childhood atopic dermatitis: the Dermatitis Family Impact Questionnaire. Br. J. Dermatol. 1998; 138 (1): 107–113.
10. Elliott B.E., Luker K. The experiences of mothers caring for a child with severe atopic eczema. J. Clin. Nurs. 1997; 6 (3): 241–247.
11. Ревякина В.А., Огородова Л.М., Деев И.А. и др. Результаты Национального многоцентрового клинико-эпидемиологического исследования атопического дерматита у детей. Аллергология. 2006; 1: 3–10.
12. Diagnosis and treatment of atopic dermatitis in children and adults: European Academy of Allergology and Clinical Immunology American Academy of Allergy, Asthma and Immunology. PRACTALL Consensus Report. J. Allergy. 2006; 61: 969–987.
13. Giusti F., Matrella A., Bertony L. Skin barrier, hydration, and pH of the skin of infants under 2 years of age. Ped. Derm. 2001; 18: 93–96.
14. Walsh P., Aeling J.L., Huff L. Hypothalamus-pituitary-adrenal axis suppression by superpotent steroids. J. Am. Acad. Dermatol. 1993; 29: 501–503.
15. Zachariae H. Renal toxicity of long-term cyclosporine. Scand. J. Reumatol. 1999; 28: 65-68.
16. Wahn U., Bos J.D., Goodfield M. et al. Efficacy and safety of pimecrolimus cream in the long-term management of atopic dermatitis in children. Pediatrics. 2002; 110: 2.
17. Harper J., Green A., Scott G. et al. First experience of topical SDZ ASM 981 in children with atopic dermatitis. Br. J. Dermatol. 2001; 144 (4): 781–787.
18. Breuer K., Werfel T., Kapp A. Safety and efficacy of topical calcineurin inhibitors in the treatment of childhood atopic dermatitis. Am. J. Clin. Dermatol. 2005; 6 (2): 65–77.
19. Simon D., Lubbe J., Wuthrich B. et al. Benefits from the use of a pimecrolimus based treatment in the management of atopic dermatitis in clinical practice. Analysis of a Swiss cohort. Dermatology. 2006; 213 (4): 313–318.
20. Papp K.A., Breuer K., Meurer M. et al. Long term treatment of atopic dermatitis with pimecrolimus cream 1% in infants does not interfere with the development of protective antibodies after vaccination. J. Am. Acad. Dermatol. 2005; 52 (2): 247–253.
21. Papp K.A., Werfel T., Folster-Holst R. et al. Long-term control of atopic dermatitis with pimecrolimus cream 1% in infants and young children: a two year study. J. Am. Acad. Dermatol. 2005; 52 (2): 240–246.
22. Hultsch T., Kapp A., Spergel J. Immunomodulation and safety of topical calcineurin inhibitors for the treatment of atopic dermatitis. Dermatology. 2005; 211 (2): 174–187.
23. Meurer M., Fartasch M., Albrecht G. et al. Long-term efficacy and safety of pimecrolimus cream 1% in adults with moderate atopic dermatitis. Dermatology. 2004; 208 (4): 365–372.
24. Gupta A.K., Chow M. Pimecrolimus: a review. J. Eur. Acad. Dermatol. Venereol. 2003; 17 (5): 493–503.
25. Eichenfield L.F., Lucky A.W., Langley R.G. et al. Use of pimecrolimus cream 1% (Elidel) in the treatment of atopic dermatitis in infants and children: the effects of ethnic origin and baseline disease severity on treatment outcome. Int. J. Dermatol. 2005; 44 (1): 70–75.
26. Lubbe J., Friedlander S.F., Cribier B. et al. Safety, efficacy, and dosage of 1% pimecrolimus cream for the treatment of atopic dermatitis in daily practice. Am. J. Clin. Dermatol. 2006; 7 (2): 121–131.
27. Kapp A., Papp K., Bingham A. et al. Long-term management of atopic dermatitis in infants with topical pimecrolimus, a nonsteroid anti–inflammatory drug. J. Allergy Clin. Immunol. 2002; 110 (2): 277–284.
28. McKenna S.P., Whalley D., de Prost Y. et al. Treatment of paediatric atopic dermatitis with pimecrolimus (Elidel, SDZ ASM 981): impact on quality of life and health-related quality of life. J. Eur. Acad. Dermatol. Venereol. 2006; 20 (3): 248–254.
29. Staab D., Kaufmann R., Brautigam M., Wahn U. Treatment of infants with atopic eczema with pimecrolimus cream 1% improves parents’ quality of life: a multicenter, randomized trial. Pediatr. Allerg Immunol. 2005; 16 (6): 527–533.
30. Staab D., Pariser D., Gottlieb A.B. et al. Low systemic absorption and good tolerability of pimecrolimus, administered as 1% cream (Elidel) in infants with atopic dermatitis a multicenter, 3-week, open-label study. Pediatr. Dermatol. 2005; 22 (5): 465–471.
31. Whalley D., Huels J., McKenna S.P., Van Assche D. The benefit of pimecrolimus (Elidel, SDZ ASM 981) on parents’ quality of life in the treatment of pediatric atopic dermatitis. Pediatrics. 2002; 110 (6): 1133–1136.
32. Fowler J., Johnson A., Chen M., Abrams K. Improvement in pruritus in children with atopic dermatitis using pimecrolimus cream 1%. Cutis. 2007; 79 (1): 65–72.
33. Смирнова Г.И. Современная концепция лечения атопического дерматита у детей. М. 2006. 132 с.
Источник