Простой герпес самгин халдин
ММА имени И.М. Сеченова
Среди многих проблем, связанных с вирусом простого герпеса (ВПГ), особого внимания заслуживает вопрос лечения рецидивов и профилактики обострений простого герпеса (ПГ). Его актуальность в связи с увеличением степени инфицированности возбудителем и частоты клинических проявлений вирусного процесса все более возрастает. Вместе с тем успешная терапия невозможна без понимания патогенеза заболевания, что не раз подчеркивали многие исследователи. Именно его расшифровка является ключом к решению самой важной задачи, стоящей перед клиницистом, в лечении хронически персистирующей герпес–вирусной инфекции [1,2,3].
Сегодня существует достаточно большой арсенал противогерпетических средств. Однако оценка их фармакологического действия говорит о наличии всего лишь двух приоритетных направлений терапии ПГ – иммунного и этиотропного. Оба они патогенетически обоснованы. Первое базируется на восстановлении контроля системы иммунитета над латентным состоянием ВПГ в сенсорных паравертебральных ганглиях ЦНС. Второе основано на нарушении репликации и активации возбудителя в случае выхода провируса герпеса из–под иммунного контроля [4].
Терапия иммунной направленности, т.е. патогенетический подход, по–видимому, – наиболее естественный метод профилактики ПГ. Ее обоснованием служит принципиальная возможность управлять формированием и уровнем напряженности приобретенного противогерпетического иммунитета [1]. Этиотропные же препараты наиболее эффективны при купировании клинических проявлений инфекции. Но, как показывает опыт, различные средства патогенетического (иммунного) влияния позволяют добиться искомого результата далеко не во всех случаях, а противовирусные средства оказывают действие только на активные формы возбудителя.
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия.
Однако следует отметить, что анализ полученных во всех случаях клинических результатов не позволяет говорить о достижении при таких подходах достоверно значимого повышения профилактического влияния комбинированных методов лечения по сравнению с монотерапией, например, герпетической вакциной или индукторами интерферона.
Также безуспешными явились попытки разработки комплексных программ терапии, включающих использование на разных этапах лечения синтетических нуклеозидов, герпетической вакцины и иммуностимулирующих средств.
Таким образом, ни этиотропная, ни иммуностимулирующая терапия не гарантируют 100% клинического эффекта. Это связано с рядом причин, например, с хронической персистенцией возбудителя. Следствием последней является восстановление репликации ВПГ и возобновление обострений заболевания после прекращения сколь угодно продолжительного по времени приема противовирусных химиопрепаратов. Неудачи иммунокоррекции можно объяснить назначением различных по патогенетическому действию препаратов без учёта особенностей нарушений системы иммунитета [1,4].
Сложившаяся ситуация свидетельствует о необходимости дифференцированного подхода к выбору терапевтической тактики при ПГ.
С этой целью нами было проведено изучение особенностей клинического течения заболевания и углублённое исследование иммунного статуса больных. Выявленные в результате закономерности между тяжестью течения вирусного процесса и глубиной дефектов иммунитета позволили разработать методологический подход к дифференцированному выбору терапии ПГ, который имеет математическое выражение.
Иммунологические исследования включали определения интерферонового статуса (ИФС), отдельных составляющих T–клеточного звена (CD–4 и CD–8 – клетки, индекс цитотоксической активности естественных киллеров), а также цитокинового профиля (интерлейкины 1, 2, 4, 6, 8, факторы некроза опухоли) и уровня специфических иммуноглобулинов к ВПГ. Изучение иммунограмм больных ПГ позволило констатировать их неоднородность. Различия имелись как количественные, так и качественные.
Количественные варианты отличались глубиной нарушений иммунитета, в первую очередь системы интерферона и цитотоксичности естественных киллеров (ЕК). Было выделено два типа иммунной несостоятельности. При редких рецидивах она носила транзиторный характер. В случаях частых обострений имела свойства вторичного иммунодефицита со снижением уровня интерферонов и индекса активности ЕК в 2 и более раз.
Качественные различия соответствовали механизму формирования вторичного иммунодефицитного состояния. Их характеристики были связаны с медиаторами иммунитета – интерлейкинами (ИЛ) и продуцирующими их клетками. На фоне общего снижения уровня цитокинов и способности к индукции иммунокомпетентных клеток в 65% случаев отмечалось превалирование выработки ИЛ–6, в 25% – ИЛ–4. В 10% иммунограмм выявлено выраженное снижение синтеза всех исследованных ИЛ и значительное понижение функциональной активности Т–хелперов.
Выявление указанных иммунологических различий позволило сделать заключение о неоднородности иммуногенеза рецидивов ПГ, выделив несколько его вариантов (табл. 1).


Иммунологические особенности, свидетельствующие о разнообразии формирования противогерпетического ответа, наглядно подтверждают необходимость различных подходов к тактике ведения и выбору терапии больных ПГ. Это обусловлено тем, что определенные иммунологические нарушения должны восстанавливаться соответствующими патогенетически обоснованными методами.
Работа с пациентом начинается со сбора анамнеза. Выявление нами прямой корреляции между тяжестью течения вирусного процесса и глубиной дефектов иммунитета привело к созданию клинического индекса терапевтической тактики (КИТТ). Он позволяет, на основании оценки клинических составляющих заболевания, определить подход к ведению больного ПГ. Возможны два варианта – купирование каждого конкретного рецидива или системная терапия с целью профилактики последующих обострений. Раньше выбор основывался исключительно на частоте манифестаций ВПГ. Однако анализ совокупности клинических данных говорит о значимости и других анамнестических параметров.
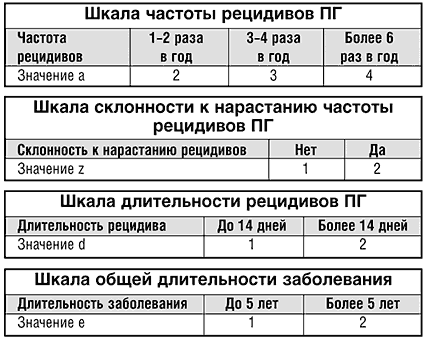
Расчёт КИТТ основан на введении в его формулу числовых значений соответствующих шкал.
КИТТ= [(a–1)x(3a+2d+e+2z–9,14)] / (3,66a–3,62),
где:
a – значение по шкале частоты рецидивов;
z – значение по шкале склонности к нарастанию частоты обострений;
d – значение по шкале их длительности;
e – значение по шкале продолжительности самого заболевания.
Наиболее важным в предложенном подходе является предупреждение о нецелесообразности «вторжения» в функцию системы иммунитета при значениях КИТТ от 0,5 до 1,3 и ограничение вмешательства при значениях от 1,6 до 1,9 (табл. 2). Несоблюдение этого может привести к срыву иммунитета и, как следствие, утяжелению течения ПГ.

При показаниях к проведению терапии направленной только на купирование рецидива наиболее эффективными препаратами являются ациклические синтетические нуклеозиды. Так, назначение Фамвира в дозе 250 мг достаточно быстро купирует клинические проявления заболевания. Однако при этом необходимо ориентировать пациента на необходимость приема противовирусных средств на ранних сроках обострения, что позволяет значительно повысить эффективность лечения.
Наряду с приведенными выше традиционными схемами применения ациклических нуклеозидов мы можем рекомендовать новую методику, которая нами условно названа «импульсной терапией». Она заключается в назначении Фамвира по 1000 мг дважды в течение одного дня. Как показывает наш личный, так и зарубежный опыт, этого бывает достаточно для полного прекращения развития рецидива при редких обострениях ПГ [5,6].
КИТТ позволяет также определить, когда пациенту показано проведение системной терапии, направленной на профилактику рецидивов. Однако он не дает ответа на вопрос о том, какой она должна быть по этиопатогенетическому действию. Это связано с тем, что сходные нарушения противовирусного иммунитета возникают при разных по характеру изменениях продукции медиаторов иммунитета и продуцирующих их клеток.
Поэтому для того, чтобы учесть это важное обстоятельство, был создан второй клинико–иммунологический индекс этиопатогенетической терапии (КИИЭПТ).
Его расчёт также основан на введении в формулу значений соответствующих шкал, где за единицу уровня продукции принято значение нормы.
КИИЭПТПГ = {[КИТТПГ + Ц(i2+f2)]x(1–t)+1} / 2 ,
где:
i – значение по шкале ИЛ–4
f – значение по шкале ИЛ–6
t – значение по шкале отношений CD–4/CD–8.
На основании анализа значений индекса и клинико–иммунологических результатов лечения больных ПГ различными методами был разработан следующий алгоритм выбора этиопатогенетической терапии заболевания, направленной на профилактику рецидивов (табл. 3).

Для пролонгированной терапии наиболее эффективными и удобными являются фамцикловир (Фамвир) (по 250 мг два раза в день) и валацикловир (по 500 мг дважды в сутки). Фамцикловир является предшественником пенцикловира и обладает рядом существенных преимуществ по сравнению с ацикловиром: высокое сродство к тимидинкиназе вируса (в 100 раз выше) и более выраженное блокирование репликации вируса между приемами препарата; фамцикловир обладает самой высокой биодоступностью (77% против 10–20% у ацикловира) и самым длительным периодом нахождения в инфицированной вирусом клетке (до 20 часов); постоянная концентрация препарата в инфицированных клетках обеспечивает длительный противовирусный эффект и дает возможность реже принимать препарат; фамцикловир обладает свойством проникать в шванновские клетки, окружающие нервные волокна. В клетках, инфицированных ВЗВ, периоды полувыведения составляют 9 часов для фосфорилированного пенцикловира и 0,8 часа для фосфорилированного ацикловира. Поэтому фамцикловир является единственным противовирусным препаратом, уменьшающий длительность постгерпетической невралгии при опоясывающем лишае (на 100 дней по сравнению с плацебо).
В качестве индукторов интерферона могут использоваться различные препараты данной группы.
Схема вакцинотерапии носит традиционный характер и состоит из двух курсов по 5 внутрикожных инъекций, при разовой дозе 0,2 мл, с интервалами 3–4 дня и двухнедельным перерывом между ними.
Для иммунозаместительной терапии наиболее эффективным препаратом сегодня является интерферон a–2b. Он назначается по одной ректальной свече, содержащей 1 млн МЕ действующего начала, дважды в сутки в течение первого месяца с последующим переходом на дозировку 500000 МЕ по той же схеме, как минимум, еще 5 месяцев.
Несомненным преимуществом данного индекса является объективный подход к назначению лечения больных ПГ. Он исключает предпочтение одних методов терапии другим. Позволяет избегать случаев утяжеления герпесвирусного процесса. Его практическое применение показало, что при подходе к лечению пациента с помощью КИИЭПТ во всех случаях достигается нормализация иммунного статуса. Как следствие этого, наблюдается 100% клинический эффект, чего не удается достичь при выборе терапии без учёта иммунологических особенностей патогенеза заболевания [7].
Литература:
1. Герпес: неизвестная эпидемия (патогенез, диагностика, клиника, лечение). Под ред. Л. Н. Хахалина, «Фармаграфикс». Смоленск. 1997, 162 с.
2. Баринский И.Ф., Шубладзе А.К., Каспаров А.А., Гребенюк В.Н. Герпес:этиология, диагностика и лечение, Медицина, Москва, 1986, 268 с.
3. Сухих Г. Т., Ванько Л. В., Кулаков В. И. Иммунитет и генитальный герпес. Нижний Новгород. 1997, 220 с.
4. Халдин А. А. Простой герпес. Российский журн. кожных и венерических болезней. 2002, №2, с. 42–50.
5. Spruance S.L., Kriesel J.D. Treatment of Herpes Simplex Labials, Herpes, V. 9, № 3, 2002, p. 64 –69
6. Spruance S.L., Jones T.M., Blatter M.M., Oral valaciclovir for the treatment of herpes labialis two trials of early, high–dose, short–course therapy. Antiviral Res., 2002, 53, A. 53.
7. Самгин М.А., Халдин А.А. Простой герпес (дерматологические аспекты), «МЕДпресс–информ», Москва, 2002, 160 с.
Источник
1. Московская медицинская академия им. И.М.Сеченова, 2. Институт доклинической и клинической экспертизы лекарственных средств ФГУ «Научный центр экспертизы средств медицинского применения» Росздравнадзора
Поражение ЦНС в виде энцефалита, менингита, энцефаломиелита и других проявлений может отмечаться и при типичной форме опоясывающего герпеса, особенно при локализации процесса на коже головы. При этом наряду с головной болью, тошнотой, рвотой, положительным симптомом Кернига–Брудзинского отмечается рассеянная микроорганическая симптоматика.
Парезы, параличи, двигательные расстройства наблюдаются при опоясывающем герпесе довольно редко, однако их возникновение возможно, например, при расположении сыпи на конечностях.
При поражении клеток коленчатого ганглия развивается триада Хунта: парез лицевого нерва, боли в ухе и пузырьковые высыпания только в аурикулярной области (по ходу пораженного нерва).
При поражении узлов блуждающего и языкоглоточного нервов наблюдаются односторонние герпетические высыпания на слизистой оболочке твердого и мягкого неба, зева, задней трети языка и глотки. Покрышки пузырьков быстро лопаются с образованием мелких болезненных эрозий с фестончатыми краями. Нередко наблюдается конъюнктивит, реже – менингеальные явления.
Диагностика
Диагноз простого герпеса, прежде всего его генитальной формы, в большинстве случаев основывается на клинической картине. Сложности возникают при атипичных проявлениях герпеса. При этом важно тщательно собрать анамнез, обращая внимание на рецидивы, сопровождающиеся зудом, жжением, неэффективностью антибиотикотерапии. Кроме того, у больного могут быть склонность к простудным заболеваниям, общая слабость, недомогания, субфебрильная температура, депрессивное состояние. Для рецидивирующего герпеса характерны волнообразное течение болезни – смена рецидивов ремиссиями. У женщин рецидивы герпеса могут быть связаны с определенными фазами менструального цикла.
Возникновение эрозий и язв на половых органах симулирует сифилитические поражения. Наиболее выражено это сходство при присоединении вторичной микробной инфекции, а также при нерациональной терапии.
Постановка диагноза генитального герпеса осложняется тем, что ВПГ нередко ассоциируется с некоторыми резидентными микроорганизмами аутофлоры: хламидиями, стрепто- и стафилококками, гарднереллой и др., что может определять возникновение смешанных инфекций. Кроме того, поскольку герпес может передаваться половым путем, необходимо обследование пациента для исключения других заболеваний, передаваемых половым путем, в том числе сифилиса и СПИДа.
В сложных случаях, когда клинических данных недостаточно, возможна лабораторная диагностика. Существует ряд специфических лабораторных исследований для распознавания ВПГ-инфекции: выделение ВПГ в культуре клеток, включая типирование ВПГ-I и ВПГ-II, тесты для определения антигена или ДНК ВПГ при помощи полимеразной цепной реакции; серологические тесты – реакция связывания комплемента, иммуноферментный анализ, непрямая реакция иммунофлюоресценции, реакция обратной пассивной гемагглютинации, белок-специфичные иммунные тесты (иммуноблоттинг), цитологическое исследование (выявление в соскобе из очага поражения многоядерных гигантских клеток).
Лечение
Лечение простого герпеса комплексное, направлено как на угнетение репликации ВПГ, так и на повышение иммунореактивности организма с учетом стадии заболевания, частоты рецидивов.
Наиболее эффективны препараты специфического противовирусного действия: ацикловир 200 мг 5 раз в день 5–10 дней; фамцикловир 250 мг 3 раза в сутки 5–10 дней; валацикловир 500 мг 2 раза в сутки 5–10 дней. Лучший эффект достигается при начале приема препарата уже во время «предвестников» рецидива, так как данные лекарственные средства действуют на ВПГ только во время его репликации. В тяжелых случаях необходимо парентеральное введение препаратов (ацикловир внутривенно капельно 5 мг/кг каждые 8 ч). Проведение иммунокоррекции возможно только под контролем иммунного статуса больного, под наблюдением врача-иммунолога в межрецидивный период. Перспективным является применение Виферона в виде ректальных свечей – по 1 свече 3 млн ЕД в день в течение 16 дней. Стоит еще раз повторить, что иммунокоррекция должна проводиться только под контролем врача-иммунолога.
Местная терапия
Наиболее эффективным средством для местной терапии оказался рекомбинантный альфа2-итерферон. Это не удивительно, так как именно альфа-интерферон играет наиболее важную роль при санации острой вирусной инфекции, которой собственно и является рецидив простого герпеса. Особенно хочется выделить новую лекарственную форму для местной терапии простого герпеса – гель Виферон.
Основной компонент геля Виферон – человеческий рекомбинантный альфа2 интерферон обладает выраженным противовирусным действием. Природный антиоксидант – витамин Е и его синергисты – бензойная и лимонная кислоты, метионин – способствуют стабилизации клеточных мембран, обладают ранозаживляющим действием. Гелевая основа обеспечивает пролонгацию воздействия препарата, а вспомогательные вещества – стабильность специфической активности и надлежащую микробиологическую чистоту препарата.
Местное использование препарата Виферон в форме геля в терапии заболеваний, вызванных вирусами герпеса, патогенетически обосновано. Таким обоснованием служат проведенные исследования по состоянию местного иммунитета в локусах традиционных высыпаний, а также изучение биологии вируса при формировании пузырьковых элементов. Так, в ряде работ было показано, что наряду с системным иммунодефицитом, лежащим в основе реактивации вируса простого герпеса, наблюдается снижение местной резистентности кожи и слизистых оболочек материальным субстратом которого главным образом являются В- и Т-лимфоциты: макрофаги, нейтрофильные лейкоциты и кератиноциты. Изучение механизмов персистенции и репликации герпес-вирусной инфекции показало, что, возможно, полный цикл репродукции ВПГ и выход полноценных вирионов происходит именно в эпителиальных клетках, т.е. в процессе формирования везикул, когда возбудитель проявляет свое цитопатическое действие. Также в ряде работ при электронной микроскопии гистологических биоптатов кожи были получены данные о наличии возбудителя в виде провируса в местах традиционных клинических проявлений в период ремиссии заболевания. С одной стороны, этот факт свидетельствует в пользу динамической теории развития рецидива простого герпеса, а с другой, полностью обосновывает необходимость включения местных противовирусных средств в комплексную терапию обострений герпетического процесса.
По рекомендациям Российского герпес-форума, назначение местных противовирусных средств целесообразно в качестве дополнительного компонента к системной противовирусной терапии начиная с момента появления «предвестников» рецидива. Монотерапия наружными средствами целесообразна при обращении пациента на высоте обострения с целью сокращения длительности кожных проявлений вирусного процесса.
Целесообразность проведения местной противовирусной терапии также подтверждается данными последних исследований. Было обнаружено, что созревание вирионов происходит и в кожном покрове. Таким образом, помимо системной терапии, для получения хорошего эффекта желательно использовать и местные лекарственные средства, в частности гель Виферон.
Существуют данные об исследованиях клинической эффективности геля Виферон, проведенных на кафедре кожных и венерических болезней лечебного факультета проф. А.А.Халдиным и доц. М.А.Самгиным. Под наблюдением находилось 60 пациентов (из них 34 женщины и 26 мужчин) с лабиальной (30 человек), генитальной (25 человек) и глютеальной (5 человек) локализацией простого герпеса. Длительность заболевания колебалась от 1 года до 6 лет, а частота рецидивов продолжительностью от 7 до 20 дней составляла в среднем 4–6 раз в год.
Сроки назначения лечения зависели от момента обращения больного, но всегда приходились на 2–4-й день развития клинической симптоматики. Гель назначался 4 раза в день на пораженные участки кожи или видимые слизистые.
В результате наблюдения отмечена крайне выраженная динамика стихания субъективной местной симптоматики, которая полностью купировалась к концу первых суток лечения. Сроки же регресса кожных высыпаний были сравнимы с таковыми при лечении мазью Виферон и составляли в среднем 3–4 дня. Однако необходимо отметить, что несколько человек, которые до этого применяли мазь, отметили более быстрое исчезновение сыпи при использовании геля. Лечение все больные переносили хорошо и каких-либо кожных реакций не наблюдалось. Как заметили исследователи, немаловажным аспектом местного применения интерферонов является и то, что к ним не развивается резистентности. Это, в частности, подтверждается и нашим наблюдением больных, которые в течение долгого времени использовали Виферон для купирования очередных обострений простого герпеса с неизменно хорошим результатом.
Отдельно хочется обратить внимание на возможность использования геля Виферон как средства профилактики простого герпеса при половых контактах. Форма препарата в виде геля позволяет без труда наносить его на слизистые оболочки половых органов, что дает возможность при профилактическом применении геля Виферон свести риск заражения ВПГ или рецидива простого герпеса при половом контакте к минимуму.
Таким образом, гель Виферон – эффективное средство как для лечения, так и для профилактики простого герпеса. Простота в применение, хорошая переносимость, сокращение длительности обострения простого герпеса, отсутствие развития резистентности у ВПГ к препарату, а главное – высокая эффективность геля Виферон выделяют этот препарат из группы средств для местной терапии простого герпеса.
Источник


